Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 11 Bài 37: Nguồn hiđrocacbon thiên nhiên chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Nguồn hiđrocacbon thiên nhiên lớp 11.
Giải bài tập Hóa học lớp 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
Câu hỏi và bài tập ( trang 169 SGK Hóa học 11)
Bài 1 trang 169 SGK Hóa học 11: Hãy cho biết thành phần dầu mỏ. Tại sao dầu mỏ không có nhiệt độ sôi nhất định? có thể biểu thị thành phần của dầu mỏ bằng một công thức phân tử nhất định được không? Tại sao?
Lời giải:
- Thành phần dầu mỏ: là hỗn hợp của rất nhiều các hiđrocacbon khác nhau, thành phần cơ bản gồm các loại ankan, xicloankan, aren ngoài ra còn 1 só lượng nhỏ các chất hữu cơ chứa oxi, nito, lưu huỳnh và vết các chất hữu cơ.
- Lý do dầu mỏ không có nhiệt độ sôi nhất định vì
Một cách chính xác thì dầu mỏ là hỗn hợp của các hiđrocacbon, là hợp chất của hiđro và cacbon. Nên nó không có nhiệt độ sôi nhất định.
Trong điều kiện thông thường, bốn ankan nhẹ nhất — CH4 (metan), C2H6 (etan), C3H8 (propan) và C4H10 (butan) — ở dạng khí, sôi ở nhiệt độ -161.6 °C, -88.6 °C, -42 °C, và -0.5 °C tương ứng (-258.9°, -127.5°, -43.6°, và -31.1 °F).
- Dầu mỏ không có công thức nhất định cũng vì lý do trên.
Thành phần chính của dầu mỏ là metan , etan , butan , và propan .Còn có rất nhiều các chất khác nhưng tỷ lệ 4 chất này là nhiều nhất.
Bài 2 trang 169 SGK Hóa học 11: Khí thiên nhiên, khí dầu mỏ, khí lò cốc là gì ? Nêu thành phần chính của mỗi loại khí này và ứng dụng của nó.
Lời giải :
- Khí thiên nhiên có trong các mỏ khí riêng biệt, khí dầu mỏ có trong các mỏ dầu.
- Thành phần gồm: metan (trong khí thiên nhiên metan chiếm từ 75-95%), etan, propan, butan, pentan và một số khí vô cơ khác ( như nito, hidro,hidrosunfua,...)
- Khí lò cốc: là hỗn hợp các chất dễ cháy. thành phần phụ thuộc vào nguyên liệu ban đầu nhưng hàm lượng trung bình các chất theo thành phần phần trăm thể tích.( tham khảo sgk trang 168)
-Ứng dụng:làm nhiên liệu cho các nhà mấy nhiệt điện.
Bài 3 trang 169 SGK Hóa học 11: Trình bày tóm tắt quy trình chưng cất dầu mỏ , các phân đoạn và ứng dụng của chúng. Có mấy loại than chính? Thành phần và cách chế biến chúng.
Lời giải:
Sơ đồ chưng cất dầu mỏ
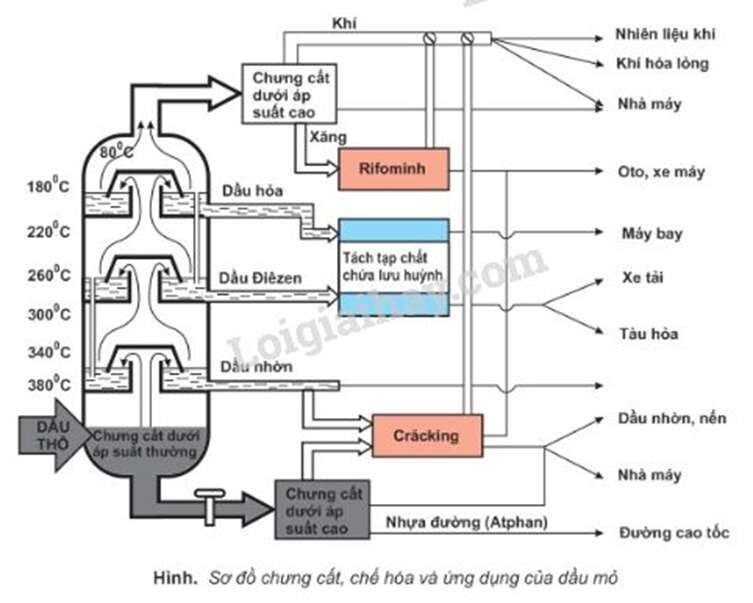
Dầu khai thác từ mỏ lên gọi là dầu thô. Dầu thô sau khi sơ chế loại bỏ nước, muối, được chưng cất ở áp suất thường trong các tháp chưng cất phân đoạn liên tục cao vài chục mét. Nhờ vậy người ta tách được những phân đoạn dầu có nhiệt độ sôi khác nhau. Các phân đoạn đó được đưa đi sử dụng hoặc được chế biến tiếp.
Các sản phẩm chưng cất dầu mỏ ở áp suất thường
Trong các loại than mỏ (than gầy, than béo, than bùn,…) hiện nay chỉ có than béo (than mỡ) được dùng để chế biến than cốc và cung cấp một lượng nhỏ hiđrocacbon. Than gầy chủ yếu dùng làm nhiên liệu cho các nhà máy nhiệt điện, xi măng, vv…
Bài 4 trang 169 SGK Hóa học 11: Một loại khí thiên nhiên có thành phần phần trăm về thể tích các khí như sau: 85% metan; 10,0% etan; 2,0% nitơ và 3,0% cacbon đioxit.
a) Tính thể tích khí (đo ở điều kiện tiêu chuẩn) cần để đun nóng 100,0 lít nước từ 20,0oC lên 100oC, biết nhiệt lượng tỏa ra khi đốt 1 mol metan, 1 mol etan lần lượt bằng: 880,0 kJ; 1560,0 kJ và để nâng 1 ml nước lên 10 cần 4,18 J.
b) Nếu chuyển được toàn bộ hiđrocacbon trong 1,000.103 m3 khí trên (đktc) thành axetilen, sau đó thành vinyl clorua với hiệu suất toàn bộ quá trình bằng 65,0% thì sẽ thu được bao nhiêu kilogram vinyl clorua?
Phương pháp giải:
a) Nhiệt lượng cần để để đun nóng 100 lít nước từ 20oC lên 100oC
[4,18x(100 – 20).105 = 334.105 (J) = 334.102 KJ.
Gọi số mol khí thiên nhiên là x mol.
Vậy: số mol CH4 là 0,85x mol; số mol C2H6 là 0,1x mol.
Do đó: 0,85x mol CH4 tỏa ra nhiệt lượng là: 880 x 0,85x = 748 (kJ).
0,1x mol C2H6 tỏa ra nhiệt lượng là 1560 x 0,10x = 156x (kJ).
Ta có: 748x + 156x = 334x102 => x = ? mol.
b) Viết PTHH xảy ra, tính toán theo PTHH
Lời giải :
a) Nhiệt lượng cần để để đun nóng 100 lít nước từ 20oC lên 100oC
[4,18x(100 – 20).105 = 334.105 (J) = 334.102 KJ.
Gọi số mol khí thiên nhiên là x mol.
Vậy: số mol CH4 là 0,85x mol; số mol C2H6 là 0,1x mol.
Do đó: 0,85x mol CH4 tỏa ra nhiệt lượng là: 880 x 0,85x = 748x (kJ).
0,1x mol C2H6 tỏa ra nhiệt lượng là 1560 x 0,10x = 156x (kJ).
Ta có: 748x + 156x = 334x102 => x = 36,9 mol.
Vậy, thể tích khí thiên nhiên cần dùng để đun nóng 100 lít nước từ 20oC lên 100oC là 22,4x = 827 lít.
b) 827 lít khí thiên nhiên có 0,85x mol CH4 và 0,1x mol C2H6
106 lít khí thiên nhiên có a mol CH4 và b mol C2H6.
a = = 3,79x104 (mol) CH4
b = = 4,46.103 (mol) C2H6.
2C2H4 → C2H2 → C2H3Cl
2 mol 1mol
3,79.104 mol 1,9.104 mol
C2H6 → C2H2 → C2H3Cl
1 mol 1 mol
4,46.103 mol 4,46.103 mol
Số mol C2H3Cl thực tế thu được:
(1,9.104 + 4,46.103)x0,65 = 1,52.104 (mol)
Khối lượng C2H3Cl thực tế thu được:
1,52.104 x 62,5 = 95.104 (g) = 950 kg.
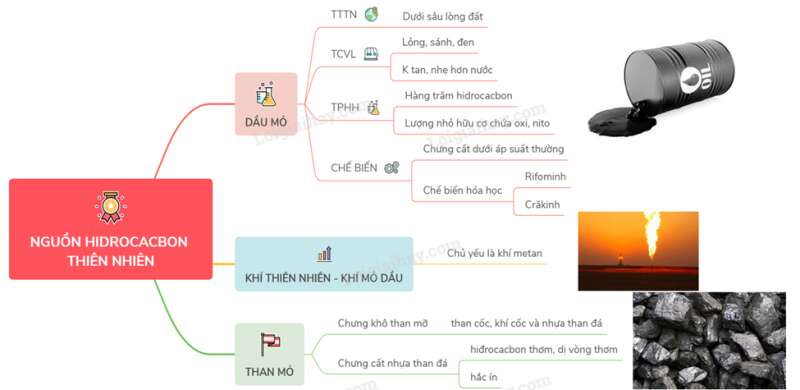
I. DẦU MỎ
1. Trạng thái thiên nhiên, tính chất vật lý
- Dầu mỏ là một hỗn hợp lỏng, sánh, màu nâu đen, có mùi đặc trưng, nhẹ hơn nước và không tan trong nước. Dầu mỏ được khai thác từ các mỏ dầu dưới lòng đất (trong lục địa cũng như ngoài thềm lục địa).
2. Thành phần hóa học
- Dầu mỏ là một thành phần hóa học phức tạp gồm hàng trăm hiđrocacbon thuộc các loại ankan, xicloankan, aren (hiđrocacbon thơm).
- Ngoài hiđrocacbon ra, trong dầu mỏ còn có một lượng nhỏ các chất hữu cơ chứa oxi, nitơ, lưu huỳnh và vết các chất vô cơ.
3. Chế biến
a) Chưng cất dưới áp suất thường
- Dầu khai thác từ mỏ lên gọi là dầu thô.
- Dầu thô sau khi sơ chế loại bỏ nước, muối, được chưng cất ở áp suất thường trong các tháp chưng cất phân đoạn liên tục cao vài chục mét.
- Nhờ vậy, người ta tách được những phân đoạn dầu có nhiệt độ sôi khác nhau.
b) Chế biến hóa học
- Hai phương pháp chủ yếu chế hóa dầu mỏ là rifominh và crackinh:
+ Rifominh: Xăng thu được từ chưng cất dầu mỏ chứa chủ yếu là những ankan không nhánh vì vậy có chỉ số octan thấp. Để tăng chỉ số octan, người ta dùng phương pháp rifominh.
+ Crăkinh là quá trình bẻ gãy phân tử hiđrocacbon mạch dài thành các phân tử hiđrocacbon mạch ngắn hơn nhờ tác dụng của nhiệt (crăkinh nhiệt) hoặc của xúc tác và nhiệt (crăkinh xúc tác).
II. KHÍ THIÊN NHIÊN VÀ KHÍ MỎ DẦU
- Khí mỏ dầu có trong các mỏ dầu, khí thiên nhiên có trong các mỏ khí riêng biệt. Thành phần: metan (trong khí thiên nhiên có trong các mỏ khí riêng biệt, Thành phần gồm: metan (trong khí thiên nhiên metan chiếm từ 75 – 95%), etan, propan, butan, pentan và một số khí vô cơ khác (như nitơ, hiđro, hiđrosusunfua,…)
- Khí mỏ dầu và khí thiên nhiên của Việt Nam chứa rất ít hợp chất lưu huỳnh.
III. THAN MỎ
- Chưng khô than mỡ thu được than cốc, khí cốc và nhựa than đá.
- Chưng cất nhựa than đá thu được hiđrocacbon thơm, dị vòng thơm và các dẫn xuất của chúng. Cặn còn lại là hắc ín.
Sơ đồ tư duy: Nguồn Hiđrocacbon thiên nhiên