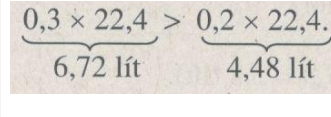Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 8 Bài 33: Điều chế hidro - Phản ứng thế chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 8. Mời các bạn đón xem:
Giải SBT Hóa học 8 Bài 33: Điều chế hidro - Phản ứng thế
Bài 33.1 trang 46 SBT Hóa học 8: Cho các phản ứng hoá học sau :
(1) Cu + 2AgNO3 Cu(NO3)2 + 2Ag
(2) Na2O + H2O 2NaOH
(3) Fe + 2HCl FeCl2 + H2
(4) CuO + 2HCl CuCI2 + H2O
(5) 2Al + 3H2SO4 Al2(SO4)3 + 3H2
(6) Mg + CuCl2 MgCl2 + Cu
(7) CaO + CO2 CaCO3
(8) HCl + NaOH NaCl + H2O
Số phản ứng thuộc loại phản ứng thế là
A. 3. B. 4. C. 5. D. 6
Lời giải:
Đó là các phản ứng (1), (3), (5), (6)
=> Chọn B.
Bài 33.2 trang 47 SBT Hóa học 8: Một học sinh làm các thí nghiệm sau :
(1) Cho dung dịch axit HCl tác dụng với đinh Fe sạch.
(2) Đun sôi nước.
(3) Đốt một mẩu cacbon.
Hỏi :
a) Trong những thí nghiệm nào có sản phẩm mới xuất hiện, chất đó là chất gì ?
b) Trong thí nghiệm nào có sự biểu hiện của thay đổi trạng thái ?
c) Trong thí nghiệm nào có sự tiêu hao oxi ?
Lời giải:
a) Những thí nghiệm có sản phẩm mới xuất hiện là :
Sắt (II) clorua Khí hiđro
Khí cacbonic
Sản phẩm mới: Ở thí nghiệm (1) là FeCl2 và H2 ; ở thí nghiệm (3) là khí CO2
b) Trong thí nghiệm (2), nước có sự thay đổi trạng thái. .
c) Thí nghiệm (3) có sự tiêu hao oxi, do sự cháy.
Bài 33.3 trang 47 SBT Hóa học 8: a) Viết phương trình hoá học của phản ứng điều chế hiđro trong phòng thí nghiệm.
b) Nguyên liệu nào được dùng để điều chế H2 trong phòng thí nghiệm, trong công nghiệp ?
Lời giải:
a) Phương trình hoá học của phản ứng điều chế hiđro trong phòng thí nghiệm : Kim loại + Axit HCl (hoặc axit H2SO4 loãng) Muối + H2
b) Nguyên liệu để điều chế H2 trong phòng thí nghiệm :
- Chọn kim loại thích hợp như : Fe, Zn, Al, Mg.
- Chọn những axit thích hợp như : HCl, H2SO4 loãng (không dùng axit nitric HNO3)
Nguyên liệu để điều chế H2 trong công nghiệp :
- Chủ yếu từ khí thiên nhiên. Khí này chủ yếu chứa metan có lẫn O2 và hơi nước.
Tách hiđro từ khí than cốc hoặc từ khí chế biến dầu mỏ, được thực hiện bằng cách làm lạnh, ở đó tất cả các khí, trừ hiđro, đều bị hoá lỏng.
Bài 33.4 trang 47 SBT Hóa học 8: Một em học sinh tự làm thí nghiệm ở nhà, cho đinh sắt sạch vào giấm ăn (dung dịch axit axetic CH3COOH).
Thí nghiệm trên và thí nghiệm điều chế hiđro trong sách giáo khoa (bài 33) có những hiện tượng gì khác nhau, em hãy so sánh. Cho biết khí thoát ra là khí gì. Cách nhận biết.
Phương pháp giải:
Gợi ý: So với thí nghiệm SGK thì nghiệm này có tốc độ phản ứng chậm hơn.
Lời giải:
- So với thí nghiệm trong sách giáo khoa, thí nghiệm này có ít bọt khí xuất hiện trên bề mặt mảnh sắt, khí thoát ra khỏi dung dịch giấm ăn chậm, mảnh sắt tan dần chậm hơn mảnh Zn.
- Khí thoát ra là khí hiđro.
- Nhận biết:
+ Đưa que đóm còn tàn đỏ vào đầu ống dẫn khí, khí thoát ra không làm cho than hồng bùng cháy.
+ Đưa que đóm đang cháy vào đầu ống dẫn khí, khí thoát ra sẽ cháy được trong không khí với ngọn lửa màu xanh nhạt, đó là khí hiđro.
Bài 33.5 trang 47 SBT Hóa học 8: Trong phòng thí nghiệm có các kim loại kẽm và magie, các dung dịch axit sunfuric loãng H2SO4 và axit clohiđric HCl.
a) Hãy viết các phương trình hoá học của phản ứng để điều chế khí H2.
b) Muốn điều chế được 1,12 lít khí hiđro (đktc) phải dùng kim loại nào, axit nào để chỉ cần một khối lượng nhỏ nhất ?
Phương pháp giải:
a) Xem lại lí thuyết Điều chế hiđro
+) Tính theo PTHH tính số mol kim loại với mỗi phương trình
+) Tính khối lượng từng kim loại, so sánh => Kết luận.
Lời giải:
a) Phương trình hoá học của phản ứng điều chế H2:
Zn + 2HCl ZnCl2 + H2 (1)
Zn + H2SO4 ZnSO4 + H2 (2)
Mg + 2HCl MgCl2 + H2 (3)
Mg + H2SO4 MgSO4 + H2 (4)
b) =
Để điều chế 0,05 mol H2 thì nZn = nMg = 0,05 mol
Mà MMg < MZn
dùng Mg sẽ cần khối lượng nhỏ hơn
Dùng axit HCl sẽ cần khối lượng nhỏ hơn
Nên với những chất đã cho muốn dùng với khối lượng nhỏ nhất để điều chế H2 ta dùng Mg và axit HCl
Bài 33.6 trang 47 SBT Hóa học 8: Trong giờ thực hành hoá học, học sinh A cho 32,5 g kẽm vào dung dịch H2SO4 loãng, học sinh B cho 32,5 g sắt cũng vào dung dịch H2SO4 loãng ở trên. Hãy cho biết học sinh nào thu được khí hiđro nhiều hơn (đo ở cùng điều kiện nhiệt độ, áp suất).
Phương pháp giải:
+) Tính số mol mỗi kim loaị.
+) Viết PTHH:
+) Tính theo phương trình => số mol hiđro
+) So sánh số mol hiđro ở (1) và (2) => Kết luận
Lời giải:
Phương trình hóa học :
0,5 mol 0,5 mol
0,58 mol 0,58 mol
Học sinh B thu được số mol nhiều hơn.
Bài 33.7 trang 47 SBT Hóa học 8: Trong giờ thực hành hoá học, một học sinh nhúng một đinh sắt vào dung dịch muối đồng sunfat CuSO4. Sau một thời gian, lấy đinh sắt ra khỏi dung dịch muối. Thanh sắt bị phủ một lớp màu đỏ gạch và dung dịch có muối sắt(II) sunfat FeSO4.
a) Hãy viết phương trình hoá học.
b) Hãy cho biết phản ứng trên thuộc loại phản ứng nào.
Lời giải:
a) Phương trình hóa học:
b) Phản ứng trên là phản ứng thế, nguyên tử Fe đã thế chỗ nguyên tử Cu trong .
Bài 33.8 trang 48 SBT Hóa học 8: Cho 6,5 g kẽm vào bình dung dịch chứa 0,25 mol axit clohiđric.
a) Tính thể tích khí hiđro thu được ở đktc.
b) Sau phản ứng còn dư chất nào ? Khối lượng là bao nhiêu gam ?
Phương pháp giải:
+) Tính số mol Zn và HCl.
+) PTHH:
+) So sánh số mol chất tham gia phản ứng để biết sau phản ứng chất nào dư. Sản phẩm được tính theo chất phản ứng hết.
Lời giải:
a) Phương trình hóa học :
1 mol 2 mol 1 mol
Tỷ lệ mol
Vậy Zn hết, HCl dư
thu được: 0,1 x 22,4 = 2,24(lít)
b) Chất dư là HCl:
Theo phương trình hóa học trên, số mol và khối lượng HCl dư là:
Bài 33.9 trang 48 SBT Hóa học 8: Cho mạt sắt vào một dung dịch chứa 0,2 mol H2SO4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và người ta thu được 1,68 lít khí hiđro (đktc).
a) Viết phương trình hoá học.
b) Tính khối lượng mạt sắt đã phản ứng.
c) Để có lượng sắt tham gia phản ứng trên, phải cho bao nhiêu gam sắt(III) oxit tác dụng với khí hiđro ?
Phương pháp giải:
a)
b) +) Tính số mol hiđro
+) Tính theo PTHH => số mol Fe => khối lượng Fe đã phản ứng.
c) +) PTHH:
+) Tính theo PTHH => số mol sắt(III) oxit => khối lượng sắt(III) oxit cần dùng.
Lời giải:
a) Phương trình hóa học:
b) Khối lượng mạt sắt đã phản ứng:
1 mol 1 mol 1mol
0,075 mol 0,075 mol 0,075 mol ( )
Theo phương trình hóa học trên ta nhận thấy số mol axit cho dư (0,2 mol), nên tính khối lượng mặt sắt theo số mol hidro:
c) Phương trình hóa học :
1 mol 3 mol 2 mol
x mol 0,075 mol
Khối lượng cần dùng để điều chế lượng sắt trên là:
Bài 33.10 trang 48 SBT Hóa học 8: Người ta cho kẽm hoặc sắt tác dụng với dung dịch axit clohiđric HCl để điều chế khí hiđro. Nếu muốn điều chế 2,24 lít khí hiđro (đktc) thì phải dùng số gam kẽm hoặc sắt lần lượt là
A. 6,5 g và 5,6 g. B. 16 g và 8 g.
C. 13 g và 11,2 g. D. 9,75 g và 8,4 g.
Phương pháp giải:
+) Tính số mol hiđro
+) PTHH:
+) Tính theo PTHH => khối lượng kim loại cần dùng.
Lời giải:
Phương trình hóa học :
1 mol 1 mol
0,1 mol 0,1 mol
1 mol 1 mol
0,1 mol 0,1 mol
=> Chọn A.
Bài 33.11 trang 48 SBT Hóa học 8: Điện phân hoàn toàn 2 lít nước ở trạng thái lỏng (biết khối lượng riêng D của nước là 1 kg/lít), thể tích khí hiđro và thể tích khí oxi thu được (ở đktc) lần lượt là
A. 1244,4 lít và 622,2 lít.
B. 3733,2 lít và 1866,6 lít.
C. 4977,6 lít và 2488,8 lít.
D. 2488,8 lít và 1244,4 lít.
Phương pháp giải:
+) PTHH:
+) Tính số mol nước dựa vào công thức: D=m/V và n= m/M
+) Tính theo PTHH => số mol H2 và O2
+) Tính thể tích từng khí.
Lời giải:
Theo phương trình:
lít
lít
Bài 33.12 trang 48 SBT Hóa học 8: So sánh thể tích khí hiđro (đktc) thu được trong mỗi trường hợp sau :
a) 0,1 mol Zn tác dụng với dung dịch H2SO4 loãng, dư.
0,1 mol Al tác dụng với dung dịch H2SO4 loãng, dư.
b) 0,2 mol Zn tác dụng với dung dịch HCl dư.
0,2 mol Al tác dụng với dung dịch HCl dư.
Phương pháp giải:
+) Viết PTHH của phản ứng.
+) Dựa theo phương trình, tính số mol H2 thu được.
+) So sánh thể tích khí hiđro thu được trong mỗi trường hợp => Kết luận.
Lời giải:
a) Phương trình hóa học:
1 mol 1 mol
0,1 mol 0,1 mol
2 mol 3 mol
0,1 mol x mol
Thể tích khí hidro do 0,1 mol nhôm sinh ra nhiều hơn 0,1 mol kẽm sinh ra:
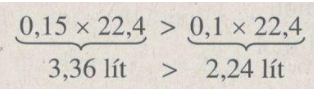
b) Phương trình hóa học:
1 mol 1 mol
0,2 mol 0,2 mol
2 mol 3 mol
0,2 mol y mol
Thể tích khí hidro do 0,2 mol nhôm sinh ra nhiều hơn do 0,2 mol kẽm sinh ra: