Với giải Bài 9.10 trang 32 SBT Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 9: Liên kết ion giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải sách bài tập Hóa học lớp 10 Bài 9: Liên kết ion
Bài 9.10 trang 32 SBT Hóa học 10: Trình bày cách vẽ một ô mạng tinh thể NaCl.
Lời giải:
Bước 1: Vẽ một khối lập phương
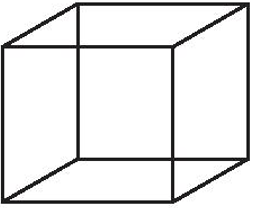
Bước 2: Chia khối lập phương đã vẽ thành 8 khối lập phương nhỏ bằng cách nối điểm giữa của mỗi cạnh với điểm giữa của cạnh đối diện và điểm giữa của mỗi mặt với điểm giữa của mặt đối diện.
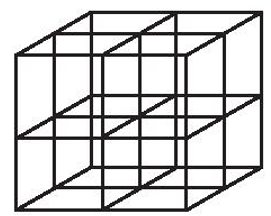
Bước 3: Đặt các ion sodium và ion chloride vào các đỉnh của khối lập phương và các điểm giữa của các cạnh cùng các mặt. Chú ý, ion chlorine có kích thước lớn hơn ion sodium. Tâm của khối lập phương không nhất thiết phải là ion sodium hay chlorine, nhưng bắt buộc các ion trái dấu phải luân phiên nhau trong không gian của mạng tinh thể.
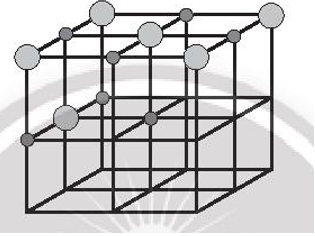
Bước 4: Tinh thể NaCl đã hoàn chỉnh:
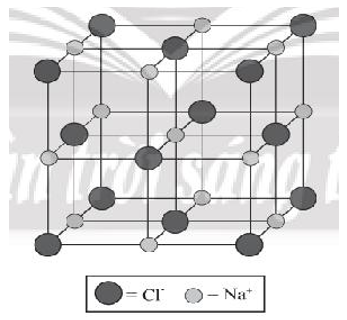
Xem thêm các bài giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 9.1 trang 30 SBT Hóa học 10: Điều nào dưới đây đúng khi nói về ion S2-?...
Bài 9.2 trang 30 SBT Hóa học 10: Điều nào dưới đây không đúng khi nói về hợp chất sodium oxide (Na2O)?...
Bài 9.3 trang 30 SBT Hóa học 10: Tính chất nào dưới đây đúng khi nói về hợp chất ion?...
Bài 9.4 trang 30 SBT Hóa học 10: Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là...
Bài 9.5 trang 31 SBT Hóa học 10: Tính chất nào sau đây không phải của magnesium oxide (MgO)?...
Bài 9.6 trang 31 SBT Hóa học 10: Sodium sulfide (Na2S) là một hợp chất hóa học được sử dụng trong ngành công nghiệp giấy và bột giấy, xử lí nước, công nghiệp dệt may và các quy trình sản xuất hóa chất khác như sản xuất cao su; thuốc nhuộm lưu huỳnh và thu hồi dầu, … Điều thú vị là sodium sulfide đã được chứng minh là có vai trò trong bảo vệ tim mạch, chống lại chứng thiếu máu cục bộ ở tim và giúp bảo vệ phổi, chống lại tổn thương phổi do máy thở. Trình bày sự tạo thành sodium sulfide khi cho sodium phản ứng với sulfur...
Bài 9.7 trang 31 SBT Hóa học 10: Chỉ ra cấu trúc đúng của ô mạng tinh thể sodium chloride:...
Bài 9.8 trang 31 SBT Hóa học 10: Magnesium chloride là một chất xúc tác phổ biến trong hóa học hữu cơ. Trình bày sự hình thành phân tử MgCl2 khi cho magnesium tác dụng với chlorine...
Bài 9.9 trang 32 SBT Hóa học 10: Trong đời sống, muối ăn (NaCl) và các gia vị, phụ gia (C5H8NO4Na: bột ngọt; C7H5O2Na: chất bảo quản thực phẩm) đều có chứa ion sodium. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo các cá nhân nên hạn chế lượng sodium xuống dưới 2 300 mg mỗi ngày vì nếu tiêu thụ nhiều hơn sẽ ảnh hưởng đến tim mạch và thận. Nếu trung bình mỗi ngày, một người dùng tổng cộng 5,0 gam muối ăn; 0,5 gam bột ngọt và 0,05 gam chất bảo quản thì lượng sodium tiêu thụ có vượt mức giới hạn cho phép nói trên không?...
Bài 9.11 trang 32 SBT Hóa học 10: Biểu đồ dưới đây cho biết mối quan hệ giữa năng lượng của hệ các ion trái dấu so với khoảng cách giữa chúng:...
Bài 9.12 trang 32 SBT Hóa học 10: X, Y, Z là các hợp chất ion thuộc trong số các chất sau: NaF, MgO và MgCl2. Nhiệt độ nóng chảy của các hợp chất X, Y, Z được thể hiện qua biểu đồ:...
Bài 9.13 trang 33 SBT Hóa học 10: Cho biết lực hút tĩnh điện được tính theo công thức sau: (q1, q2) là giá trị điện tích của hai điện tích điểm, đơn vị là C (coulomb); r là khoảng cách giữa hai điện tích điểm; đơn vị là m (meter); k là hằng số coulomb). Dựa vào công thức trên, hãy so sánh gần đúng lực hút tĩnh điện giữa các ion trái dấu trong phân tử NaCl và phân tử MgO. Từ đó, cho biết nhiệt độ nóng chảy và nhiệt độ sôi của hợp chất nào cao hơn...
Bài 9.14 trang 33 SBT Hóa học 10: Hình dạng và cấu trúc tinh thể của mọi hợp chất ion có giống nhau không? Giải thích...
Bài 9.15 trang 33 SBT Hóa học 10: Vì sao các hợp chất ion thường tồn tại ở trạng thái rắn và cứng trong điều kiện thường, nhưng lại giòn, dễ vỡ?...
Bài 9.16 trang 33 SBT Hóa học 10: Vì sao nói sodium chloride có cấu trúc mạng tinh thể kiểu lập phương tâm diện?...
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 8: Quy tắc octet
Bài 9: Liên kết ion
Bài 10: Liên kết cộng hóa trị
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống