Với giải Vận dụng 3 trang 80 Hóa học lớp 10 Cánh diều chi tiết trong Bài 14: Phản ứng hóa học và enthalpy giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 14: Phản ứng hóa học và enthalpy
Vận dụng 3 trang 80 Hóa học 10: Sự hô hấp cung cấp oxygen cho các phản ứng oxi hóa chất béo, chất đường, tinh bột, … trong cơ thể con người. Đó là các phản ứng giải phóng hay hấp thụ năng lượng? Năng lượng kèm theo các phản ứng này dùng để làm gì?
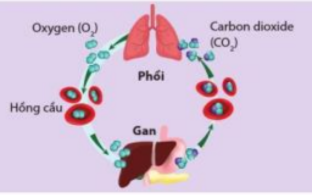
Phương pháp giải:
Sự oxi hóa chất béo, chất đường, tinh bột...trong cơ thể con người giúp giải phóng năng lượng, cung cấp năng lượng cho các hoạt động
Lời giải:
- Sự hô hấp cung cấp oxygen cho các phản ứng oxi hóa chất béo, chất đường, tinh bột,... trong cơ thể con người đó là các phản ứng giải phóng năng lượng
- Năng lượng kèm theo các phản ứng dùng để cung cấp năng lượng cho các hoạt động
Lý thuyết Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
1. Enthalpy tạo thành chuẩn của một chất hóa học
- Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là Δflà lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
- Khi phản ứng tỏa nhiệt Δf < 0.
- Khi phản thu tỏa nhiệt Δf > 0.
Ví dụ 1: Ở điều kiện chuẩn, phản ứng của 1 mol Na (thể rắn) với 0,5 mol Cl2 (thể khí) thu được 1 mol NaCl (thể rắn) và giải phóng 411,2 kJ nhiệt. Biết rằng, ở điều kiện chuẩn, Na thể rắn bền hơn Na ở thể lỏng; chlorine dạng phân tử Cl2 bền hơn dạng nguyên tử Cl.
Ta nói enthalpy tạo thành của NaCl rắn ở điều kiện chuẩn là - 411,2 kJ mol-1. Phản ứng trên được biểu diễn như sau:
Na(s) + Cl2(g) NaCl(s) Δf = - 411,2 kJmol-1
Ví dụ 2: Ở điều kiện chuẩn, cần phải cung cấp 91,3 kJ nhiệt lượng cho quá trình 0,5 mol N2(g) phản ứng với 0,5 mol O2(g) để thu được 1 mol NO(g).
Như vậy, enthalpy tạo thành chuẩn của NO ở thể khí là 91,3 kJmol-1. Phản ứng trên được biểu diễn như sau:
N2(s) + O2(g) NO(g) Δf = 91,3 kJmol-1
Lưu ý: Enthalpy tạo thành chuẩn của các đơn chất bền nhất đều bằng 0.
Ví dụ: Δf (Na(s)) = 0 kJmol-1 Δf (Cl2(g)) = 0 kJmol-1
2. Biến thiên enthalpy chuẩn của phản ứng hóa học
- Khái niệm: Biến thiên enthalpy chuẩn của một phản ứng hóa học, kí hiệu là Δr hính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng đó ở điều kiện chuẩn.
Ví dụ 1: Phản ứng đốt cháy ethanol (C2H5OH) tỏa rất nhiều nhiệt.
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(l) Δr= -1368 kJmol-1
Như vậy, ở điều kiện chuẩn khi đốt cháy hoàn toàn 1 mol C2H5OH, sản phẩm là CO2(g) và H2O(l), thì sẽ giải phóng một lượng nhiệt là 1368 kJ.
Lưu ý: Cũng phản ứng này, nếu nước ở thể hơi thì giá trị Δrsẽ khác đi. Đây là lí do cần phải ghi rõ thể của các chất khi viết phương trình các phản ứng có kèm theo giá trị Δr
Ví dụ 2: Phản ứng nhiệt phân CuO là phản ứng thu nhiệt:
2CuO(s) Cu2O(s) + O2(g) Δr= 287,4 kJmol-1
Ở điều kiện chuẩn, để thu được 1 mol Cu2O(s) từ CuO(s), cần phải cung cấp 287,4 kJ nhiệt lượng.
Ví dụ 3: Phản ứng trung hòa giữa NaOH và HCl là phản ứng tỏa nhiệt.
NaOH(aq) + HCl(aq) NaCl(aq) + H2O(l) Δr= -57,9 kJmol-1
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Mở đầu trang 77 Hóa học 10: Cho các phản ứng sau:...
Vận dụng 1 trang 78 Hóa học 10: Dự đoán các phản ứng sau là tỏa nhiệt hay thu nhiệt?...
Câu hỏi 4 trang 79 Hóa học 10: Cho phản ứng:...
Câu hỏi 5 trang 79 Hóa học 10: Vì sao enthalpy tạo thành của một đơn chất bền lại bằng không?...
Câu hỏi 6 trang 80 Hóa học 10: Giá trị của phản ứng sau là bao nhiêu kJ?...
Bài 3 trang 81 Hóa học 10: Cho biết phản ứng sau có > 0 và diễn ra ở ngay nhiệt độ phòng...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 13: Phản ứng oxi hóa - khử
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen