Với giải Luyện tập 1 trang 54 Hóa học lớp 10 Cánh diều chi tiết trong Bài 10: Liên kết ion giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 10: Liên kết ion
Luyện tập 1 trang 54 Hóa học 10: Hãy nêu một số hợp chất ion:
a) Tạo nên bởi các ion đơn nguyên tử
b) Tạo nên bởi ion đơn nguyên tử và ion đa nguyên tử
c) Tạo nên bởi các ion đa nguyên tử
Phương pháp giải:
- Hợp chất ion là các hợp chất được tạo nên từ cation và anion
- Các ion đơn nguyên tử như: Na+, Cl-, Cu2+, K+, Br-…
- Các ion đa nguyên tử như: CO32-, NH4+, NO3-…
Lời giải:
a) Hợp chất ion tạo nên bởi các ion đơn nguyên tử là: NaCl, KBr, MgCl…
b) Hợp chất ion tạo nên bởi ion đơn nguyên tử và ion đa nguyên tử là: KNO3, NH4Cl, Na2SO4…
c) Hợp chất ion tạo nên bởi các ion đa nguyên tử là: NH4NO3, (NH4)2CO3, (NH4)2SO4…
Lý thuyết Khái niệm và sự hình thành liên kết ion
1. Khái niệm
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: Liên kết ion trong hợp chất NaCl tạo bởi lực hút tính điện giữa cation Na+ và anion Cl-.
Na+ + Cl- NaCl
- Liên kết ion cũng có thể được hình thành từ ion đa nguyên tử.
Ví dụ các quá trình:
+ NH4NO3
Na+ + NaNO3
- Các hợp chất được tạo nên từ cation (ion mang điện tích dương) và anion (ion mang điện tích âm) gọi là hợp chất ion.
Lưu ý: Theo quy ước, điện tích của ion được viết số trước, dấu (+ hoặc -) sau để tránh nhầm lẫn với số oxi hóa.
Ví dụ: , ,
2. Sự hình thành liên kết ion từ phản ứng giữa các nguyên tử
- Quá trình hình thành liên kết ion diễn ra như sau:
+ Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron (tạo thành cation) và nguyên tử phi kim nhận electron (tạo thành anion) theo quy tắc octet.
+ Các ion trái dấu hút nhau bằng lực hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng 0.
Ví dụ: Quá trình hình thành liên kết ion trong phân tử NaCl:
Nguyên tử Na nhường 1 electron ở lớp electron ngoài cùng cho nguyên tử Cl để tạo thành ion dương Na+. Nguyên tử Cl nhận vào lớp electron ngoài cùng 1 electron của nguyên tử Na để tạo thành ion âm Cl-. Hai ion Na+ và Cl- được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử NaCl.
Na+ + Cl- NaCl
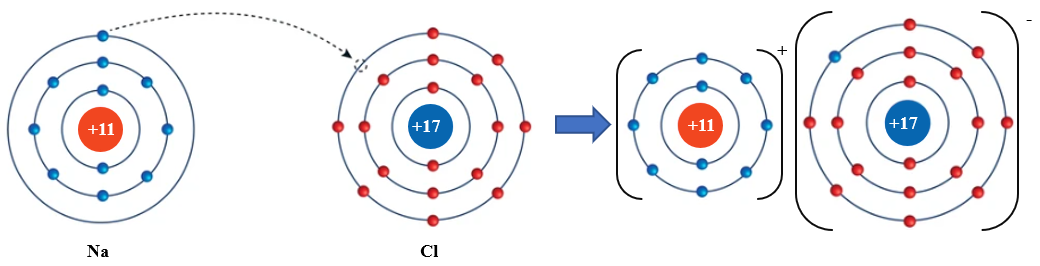
Hình 10.1. Quá trình hình thành liên kết ion trong phân tử NaCl
Nhận xét: Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Mở đầu trang 53 Hóa học 10: Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?...
Câu hỏi 1 trang 53 Hóa học 10: Phát biểu nào sau đây là đúng?...
Bài 1 trang 56 Hóa học 10: Những phát biểu nào sau đây là đúng?...
Bài 2 trang 56 Hóa học 10: Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa - khử