Với giải Luyện tập 4 trang 30 Hóa học lớp 10 Cánh diều chi tiết trong Bài 5: Lớp, phân lớp và cấu hình electron giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron
Luyện tập 4 trang 30 Hóa học 10: Dự đoán tính chất hóa học cơ bản (tính kim loại, tính phi kim) của các nguyên tố có Z từ 1 đến 20.
Phương pháp giải:
Từ cấu hình electron, có thể dự đoán các tính chất theo quy tắc sau:
Các nguyên tử có … electron ở lớp ngoài cùng
+ 1, 2, 3: nguyên tố kim loại (tính khử).
+ 5, 6, 7: nguyên tố phi kim (tính oxi hóa).
+ 8: nguyên tố khí hiếm (trừ He chỉ có 2 electron).
+ 4: nguyên tố kim loại hoặc phi kim.
Lời giải:
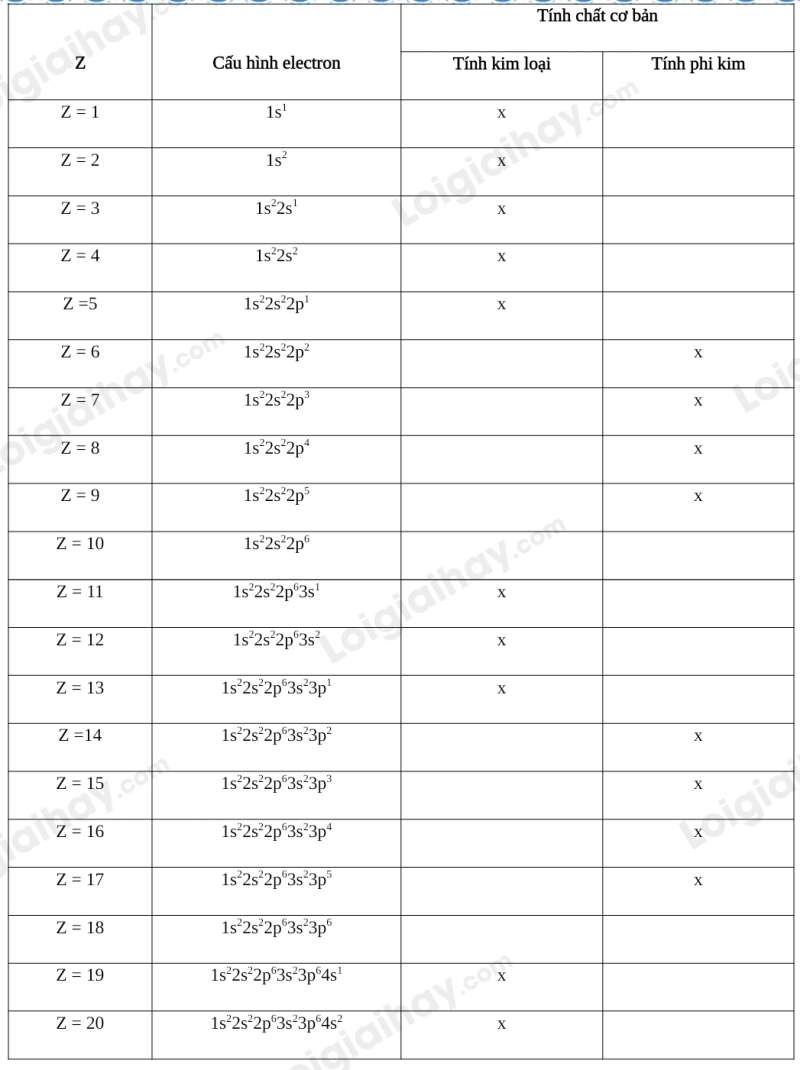
Lý thuyết Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron của nguyên tử
Các electron thuộc lớp ngoài cùng có vai trò quyết định đến tính chất hóa học đặc trưng của nguyên tố (tính kim loại, tính phi kim, tính trơ, ...). Từ cấu hình electron có thể dự đoán các tính chất này theo quy tắc sau:
- Quy tắc 1: Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố kim loại. Tính kim loại thể hiện qua khả năng nhường electron trong các phản ứng hóa học (tính khử).
Ví dụ: Nguyên tử Na (Z =11) có 1 electron ở lớp ngoài cùng nên Na là nguyên tố kim loại.
- Quy tắc 2: Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim. Tính phi kim thể hiện qua khả năng nhận electron trong các phản ứng hóa học (tính oxi hóa).
Ví dụ: Nguyên tử O (Z = 8) có 6 electron ở lớp ngoài cùng nên O là nguyên tố phi kim.
- Quy tắc 3: Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He chỉ có 2 electron) là các nguyên tử nguyên tố khí hiếm. Các nguyên tố này rất khó tham gia các phản ứng hóa học (tính trơ).
Ví dụ: Nguyên tử Ne (Z = 10) có 8 electron ở lớp ngoài cùng nên Ne là nguyên tố khí hiếm.
- Quy tắc 4: Nếu lớp electron ngoài cùng của một nguyên tử có 4 electron thì nguyên tử nguyên tố đó có thể là kim loại hoặc phi kim.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Bài 1 trang 30 Hóa học 10: Những phát biểu nào sau đây là đúng?...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học