Với giải Luyện tập 3 trang 29 Hóa học lớp 10 Cánh diều chi tiết trong Bài 5: Lớp, phân lớp và cấu hình electron giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron
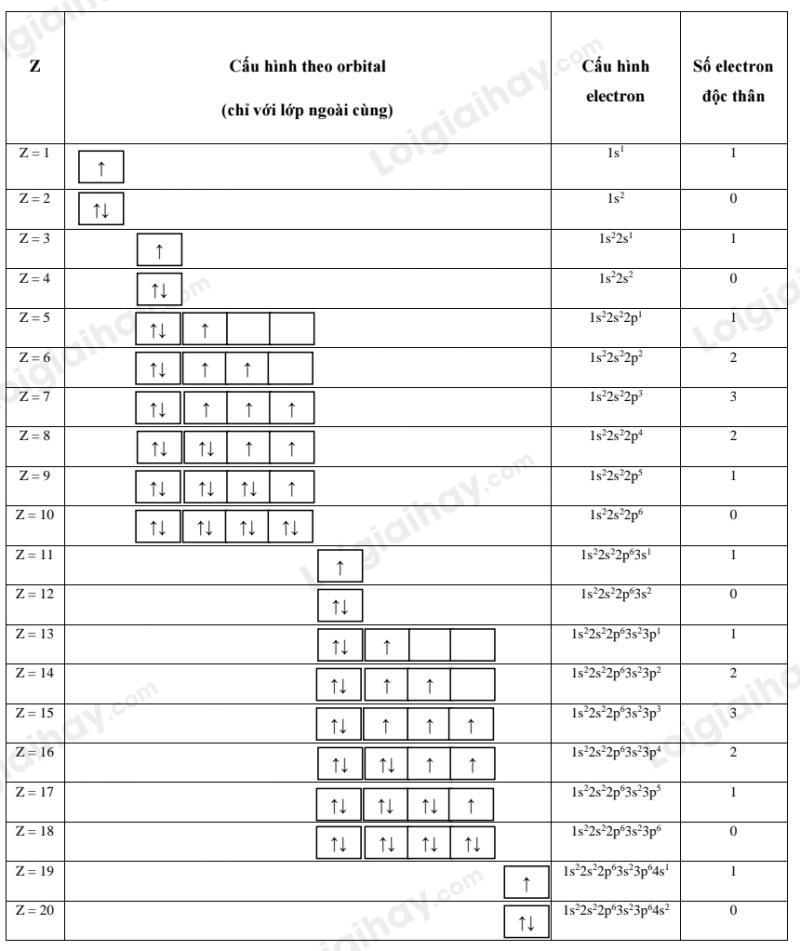
Luyện tập 3 trang 29 Hóa học 10: Biểu diễn cấu hình theo ô orbital (chỉ với lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử.
Phương pháp giải:
Chú ý:
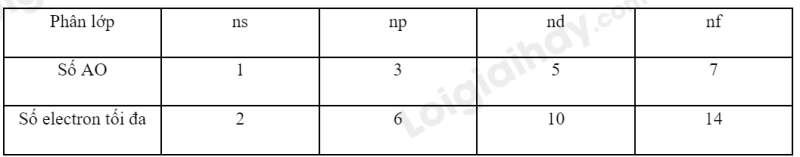
+ Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp.Chú ý:
+ Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất.
+ Electron được điền từ trái sang phải.
+ Trong mỗi ô, electron đầu tiên được biểu diễn bằng ↑, electron thứ hai được biểu diễn bằng ↓.
Lời giải:
Lý thuyết Cấu hình electron nguyên tử
1. Cách viết cấu hình electron nguyên tử
- Cấu hình electron biểu diễn sự phân bố electron vào lớp vỏ nguyên tử theo các lớp và phân lớp.
- Các bước viết cấu hình electron nguyên tử theo những nguyên tắc sau:
+ Quy tắc 1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s...
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
- Quy tắc 2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
Ví dụ: Nguyên tử Fe có Z = 26, sau khi điền electron vào dãy Klechkovski nhận được dãy 1s22s22p63s23p64s23d6. Sắp xếp lại vị trí phân lớp 4s2 và 3d6 thu được cấu hình electron là 1s22s22p63s23p63d64s2.
- Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của electron trong mỗi phân lớp tăng theo chiều từ trái qua phải.
Ví dụ: Cấu hình electron nguyên tử của oxygen là 1s22s22p4. Trong nguyên tử oxygen, năng lượng của electron thuộc phân lớp 2s cao hơn electron thuộc phân lớp 1s, năng lượng của electron thuộc phân lớp 2p cao hơn electron thuộc phân lớp 2s.
Lưu ý: Quy tắc đường chéo xác định dãy Klechkovski như sau:
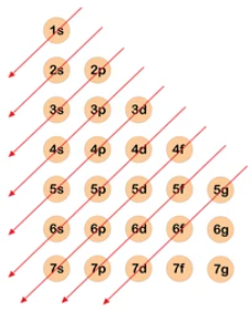
Hình 5.1. Quy tắc đường chéo xác định dãy Klechkovski
2. Biểu diễn cấu hình electron theo ô orbital
- Biểu diễn cấu hình electron theo orbital (còn gọi là cách biểu diễn cấu hình theo ô lượng tử) là một cách biểu diễn sự phân bố electron theo orbital, từ đó biết được nguyên tử có bao nhiêu electron độc thân, electron độc thân đó nằm ở orbital nào.
- Quy tắc biểu diễn cấu hình electron theo orbital:
+ Quy tắc 1: Viết cấu hình electron của nguyên tử
+ Quy tắc 2: Biểu diễn mỗi AO bằng một ô vuông (orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
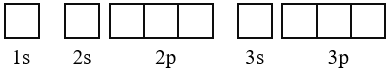
+ Quy tắc 3: Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên.
Lưu ý:
- Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các orbital theo thứ tự từ trái sang phải.
- Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
Ví dụ:
+ Nguyên tử O (Z = 8) có cấu hình electron nguyên tử là 1s22s22p4.
+ Cấu hình theo orbital của O như sau:
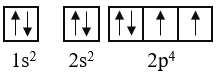
Như vậy, nguyên tử oxygen có 2 elctron độc thân, thuộc AO 2p.
Mở rộng: Electron mang điện tích âm nên hai electron trong cùng một AO sẽ đẩy nhau, vì vậy chúng có xu hướng tách nhau ra và chiếm hai AO khác nhau. Đây là lí do vì sao trong một phân lớp, các electron cần được sắp xếp sao cho số electron độc thân là lớn nhất.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Bài 1 trang 30 Hóa học 10: Những phát biểu nào sau đây là đúng?...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học