Với giải Bài 5 trang 25 Hóa học lớp 10 Cánh diều chi tiết trong Bài 4: Mô hình nguyên tử và orbital nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5 trang 25 Hóa học 10: Trả lời những câu hỏi sau đây liên quan đến mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử.
a) Vì sao còn gọi mô hình Rutherford – Bohr là mô hình hành tinh nguyên tử?
b) Theo mô hình hiện đại, orbital p có hình số tám nổi với hai phần (còn gọi là hai thùy) giống hệt nhau. Xác suất tìm thấy electron ở mỗi thùy là khoảng bao nhiêu phần trăm?
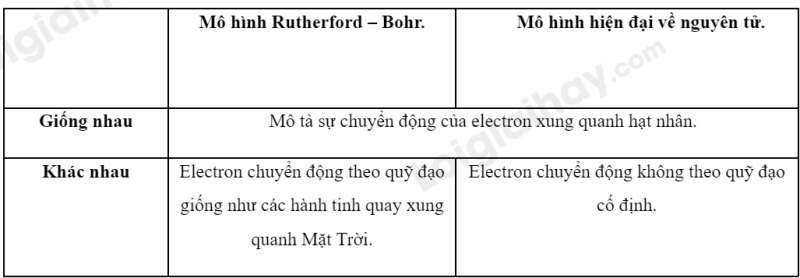
c) So sánh sự giống và khác nhau giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử.
Phương pháp giải:
- Mô hình Rutherford – Bohr.
- Mô hình hiện đại về nguyên tử.
Lời giải:
a) Vì mô hình biểu diễn electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời nên được gọi là mô hình hành tinh nguyên tử.
b) Xác suất tìm thấy electron ở mỗi thùy của orbital p là khoảng 90%.
c)
Bài tập vận dụng:
Câu 1. Phát biểu đúng khi nói về mô hình nguyên tử hiện đại là
A. Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời.
B. Electron chuyển động rất nhanh, không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy giống nhau.
C. Electron chuyển động rất nhanh, không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau.
D. Electron chuyển động rất nhanh, theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau.
Đáp án: C
Giải thích: Theo mô hình nguyên tử hiện đại: Electron chuyển động rất nhanh, không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau.
Câu 2. Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là:
A. Electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình Rutherford – Bohr) và electron chuyển động không theo quỹ đạo xác định (mô hình hiện đại);
B. Electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình hiện đại) và electron chuyển động không theo quỹ đạo xác định (mô hình Rutherford – Bohr);
C. Electron chuyển động xung quanh hạt nhân (mô hình Rutherford – Bohr) và electron chỉ chuyển động ở một khu vực nhất định bên ngoài hạt nhân (mô hình hiện đại);
D. Electron chuyển động (mô hình Rutherford – Bohr) và electron không chuyển động (mô hình hiện đại);
Đáp án: A
Giải thích:
Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là:
Electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình Rutherford – Bohr) và electron chuyển động không theo quỹ đạo xác định (mô hình hiện đại);
Câu 3. Theo mô hình Rutherford – Bohr: Theo chiều từ hạt nhân ra ngoài lớp vỏ
A. năng lượng của các electron giảm dần;
B. năng lượng của các electron không đổi;
C. năng lượng của các electron tăng dần;
D. khối lượng của các electron tăng dần;
Đáp án: C
Giải thích:
Theo mô hình Rutherford – Bohr: Theo chiều từ hạt nhân ra ngoài lớp vỏ, năng lượng của các electron tăng dần.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Câu hỏi 4 trang 23 Hóa học 10: Chọn phát biểu đúng về electron s....
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron