Với giải Câu hỏi 1 trang 21 Hóa học lớp 10 Cánh diều chi tiết trong Bài 4: Mô hình nguyên tử và orbital nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Câu hỏi 1 trang 21 Hóa học 10: Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu hay giải phóng năng lượng? Giải thích.
Phương pháp giải:
Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử. Electron ở càng xa hạt nhân thì năng lượng càng cao.
Lời giải:
- Electron ở càng xa hạt nhân thì năng lượng càng cao
=> Electron ở gần hạt nhân có mức năng lượng thấp hơn electron ở xa hạt nhân
=> Electron cần phải thu năng lượng để có thể chuyển từ lớp gần ra lớp xa hạt nhân
Lý thuyết Mô hình nguyên tử
1. Mô hình Rutherford – Bohr
- Mô hình nguyên tử của Rutherford – Bohr có các nội dung chính sau:
+ Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
+ Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
+ Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử. Electron ở càng xa hạt nhân thì có năng lượng càng cao.
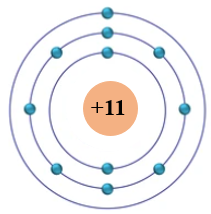
Hình 4.1. Cấu trúc nguyên tử sodium theo mô hình Rutherford – Bohr
- Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của mỗi lớp như sau:
+ Lớp thứ nhất gọi là lớp K.
+ Lớp thứ hai gọi là lớp L.
+ Lớp thứ ba gọi là lớp M.
+ Lớp thứ tư gọi là lớp N.
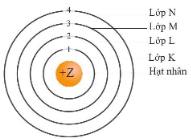
Hình 4.2. Mô hình nguyên tử theo Rutherford – Bohr
Lưu ý:
- Các electron được phân bố lần lượt vào lớp gần hạt nhân trước.
Ví dụ: Các electron được phân bố vào các lớp theo thứ tự: K, L, M, N, ...
- Số electron tối đa trong mỗi lớp là 2n2, với n là số thứ tự lớp electron (n £ 4).
Ví dụ: Dựa vào công thức này tính được lớp thứ tư (lớp N, n = 4) chứa tối đa 2.42 = 32 electron.
2. Mô hình hiện đại về nguyên tử
- Theo mô hình hiện đại về nguyên tử:
+ Các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo xác định.
+ Electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau, sự chuyển động này tạo nên một hình ảnh giống như một đám mây electron.
Ví dụ: Xác suất tìm thấy electron trong đám mây electron của nguyên tử hydrogen là khoảng 90%, nghĩa là electron dù chuyển động khắp nơi trong không gian xung quanh hạt nhân nguyên tử, nhưng tập trung phần lớn ở khu vực này.
 Hình 4.3. Minh họa đám mây electron của nguyên tử hydrogen
Hình 4.3. Minh họa đám mây electron của nguyên tử hydrogen
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Câu hỏi 4 trang 23 Hóa học 10: Chọn phát biểu đúng về electron s....
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron