Với giải Câu hỏi 4 trang 23 Hóa học lớp 10 Cánh diều chi tiết trong Bài 4: Mô hình nguyên tử và orbital nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Câu hỏi 4 trang 23 Hóa học 10: Chọn phát biểu đúng về electron s.
A. Là electron chuyển động chủ yếu trong khu vực không gian hình cầu.
B. Là electron chỉ chuyển động trên một mặt cầu.
C. Là electron chỉ chuyển động trên một đường tròn.
Phương pháp giải:
Electron s hay gọi là AO s là AO hình cầu.
Lời giải:
Đáp án đúng: A
Lý thuyết Orbital nguyên tử
1. Khái niệm
- Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Ví dụ: Khu vực không gian trong khối cầu xung quanh hạt nhân hydrogen mà xác suất tìm thấy electron tại đó là khoảng 90% chính là orbital của nguyên tử hydrogen.
- Orbial nguyên tử có một số hình dạng khác nhau.
+ AO hình cầu, còn gọi là AO s;
+ AO hình số tám nổi, còn gọi là AO p (tùy theo vị trí của AO p trên hệ trục tọa độ Đề - các, sẽ gọi là AO px, py và pz).
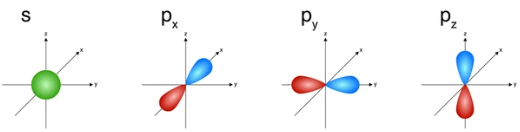
Hình 4.4. Hình dạng của AO s và AO p
Lưu ý:
- Orbital nguyên tử kí hiệu là AO (viết tắt của cụm từ tiếng Anh: Atomic Orbital).
- Các AO p trong cùng một lớp electron có hình dạng và kích thước tương tự nhau nhưng khác nhau về định hướng trong không gian.
- Ngoài các AO hay gặp là s và p, còn có các AO khác như d, f có hình dạng phức tạp hơn.
2. Số lượng electron trong một AO
- Electron chuyển động trong AO s gọi là electron s, electron chuyển động trong AO p gọi là electron p, ...
- Một AO chỉ chứa tối đa 2 electron, 2 electron này được gọi là cặp electron ghép đôi. - Nếu AO chỉ có 1 electron, electron đó được gọi là electron độc thân.
- Nếu AO không chứa electron nào thì được gọi là AO trống.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron