Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 12 Bài 10: Thế điện cực chuẩn của kim loại sách Cánh diều. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 12. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 10: Thế điện cực chuẩn của kim loại. Mời các bạn đón xem:
Trắc nghiệm Hóa học 12 Bài 10: Thế điện cực chuẩn của kim loại
Phần 1. Trắc nghiệm Thế điện cực chuẩn của kim loại
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Cho dãy sắp xếp các kim loại theo chiều giảm dần tính khử: Na, Mg, Al, Fe. Trong số các cặp oxi hoá - khử sau, cặp nào có giá trị thế điện cực chuẩn nhỏ nhất?
A. Mg2+/Mg.
B. Fe2+/Fe.
C. Na+/Na.
D. Al3+/Al.
Đáp án đúng là: C
Dạng khử có tính khử càng mạnh thì cặp oxi hoá-khử có giá trị thế điện cực chuẩn càng nhỏ.
Câu 2. Trong nước, thế điện cực chuẩn của kim loại Mn+/M càng nhỏ thì dạng khử có tính khử …(I)… và dạng oxi hoá có tính oxi hoá …(II)….
Các cụm từ cần điền vào (I) và (II) lần lượt là
A. càng mạnh và càng yếu.
B. càng mạnh và càng mạnh.
C. càng yếu và càng yếu.
D. càng yếu và càng mạnh.
Đáp án đúng là: A
Trong nước, thế điện cực chuẩn của kim loại Mn+/M càng nhỏ thì dạng khử có tính khử càng mạnh và dạng oxi hoá có tính oxi hoá càng yếu.
Câu 3. Cho phản ứng hoá học:
Cu + 2Ag+ → Cu2+ + 2Ag.
Phát biểu nào sau đây về phản ứng trên là đúng?
A. Ag+ khử Cu thành Cu2+.
B. Cu2+ có tính oxi hoá mạnh hơn Ag+.
C. Cu có tính khử yếu hơn Ag.
D. Cu là chất khử, Ag+ là chất oxi hoá.
Đáp án đúng là: D
- Sau phản ứng, số oxi hóa của Cu tăng lên sau phản ứng nên Cu thể hiện tính khử.
- Sau phản ứng, số oxi hóa của Ag giảm xuống sau phản ứng nên Ag+ thể hiện tính oxi hóa.
Câu 4. Cho thế điện cực chuẩn của các cặp oxi hoá– khử: Fe2+/Fe, Na+/Na, Ag+/Ag, Mg2+/Mg, Cu2+/Cu lần lượt là -0,44V, -2,713V, +0,799V, -2,353V, +0,340V. Ở điều kiện chuẩn, kim loại Cu khử được ion kim loại nào sau đây?
A. Na+.
B. Mg2+.
C. Ag+.
D. Fe2+.
Đáp án đúng là: C
Dựa vào thế điện cực chuẩn của các cặp oxi hoá– khử, xác định được kim loại Cu khử được Ag+.
Cu + 2Ag+ → Cu2+ + 2Ag
Câu 5. Cho thứ tự sắp xếp một số cặp oxi hoá – khử trong dãy điện hoá: Al3+/Al, Fe2+/Fe, Sn2+/Sn, Cu2+/Cu.
Kim loại nào sau đây có phản ứng với dung dịch muối tương ứng?
A. Fe và CuSO4.
B. Fe và Al2(SO4)3.
C. Sn và FeSO4.
D. Cu và SnSO4.
Đáp án đúng là: A
Dựa vào quy tắc alpha xác định được cặp Fe và CuSO4 xảy ra phản ứng.
Fe + CuSO4 → FeSO4 + Cu
Câu 6: Kí hiệu cặp oxi hoá-khử ứng với quá trình khử: Fe3+ + 1e → Fe2+ là
A. Fe3+/Fe2+.
B. Fe2+/Fe.
C. Fe3+/Fe.
D. Fe2+/Fe3+.
Đáp án đúng là: A
Cặp oxi hóa khử với dạng oxi hóa /dạng khử là: Fe3+/Fe2+.
Câu 7: Giá trị thế điện cực chuẩn của cặp oxi hoá - khử nào được quy ước bằng 0?
A. Na+/Na.
B. 2H+/H2.
C. Al3+/Al.
D. Cl2/2Cl-
Đáp án đúng là: B
Cặp oxi hoá - khử có thế điện cực chuẩn bằng 0 là 2H+/H2.
Câu 8: Cặp oxi hoá- khử nào sau đây có giá trị thế điện cực chuẩn lớn hơn 0?
A. K+/K.
B. Li+/Li.
C. Ba2+/Ba.
D. Cu2+/Cu.
Đáp án đúng là: D
Theo quy ước: Cặp oxi hóa khử của kim loại có tính khử yếu đứng sau hydrogen trong dãy điện hóa sẽ có thế điện cực chuẩn lớn hơn 0: Cu2+/Cu.
Câu 9: Trong số các ion: Ag+, Al3+, Fe2+, Cu2+, ion nào có tính oxi hoá mạnh nhất ở điều kiện chuẩn?
A. Cu2+.
B. Fe2+.
C. Ag+.
D. Al3+.
Đáp án đúng là: C
Theo thứ tự trong dãy điện hóa ion đứng sau sẽ có tính oxi hóa mạnh hơn ion đứng trước nên ion có tính oxi hóa mạnh nhất là Ag+.
Câu 10: Ở điều kiện chuẩn, kim loại nào sau đây khử được ion H+ thành H2?
A. Mg.
B. Cu.
C. Hg.
D. Au.
Đáp án đúng là: A
Kim loại Mg đứng trước H trong dãy điện hóa khử được ion H+ thành H2.
Mg + 2H+ → Mg2+ + H2
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a, b, c, d mỗi câu, hãy chọn đúng hoặc sai.
Câu 11. Cho phản ứng: Ce4+ + 2I- → I2 + Ce3+.
a) Phản ứng trên đã cân bằng
b) Chất oxi hóa là Ce4+, chất khử là I-.
c) Cặp oxi hóa – khử của kim loại cerium là Ce4+/Ce, của iodine là I2/2I-
d) Phương trình hóa học của phản ứng là 2Ce4+ + 2I- → I2 + 2Ce3+.
a. Sai vì tổng điện tích 2 vế chưa bằng nhau.
b. Đúng.
c. Sai vì cặp oxi hóa – khử của cerium là Ce4+/Ce3+
d. Đúng.
Câu 12. Khi dùng một chiếc thìa bằng đồng khuấy vào cốc chứa dung dịch aluminium nitrate.
a) Chiếc thìa bị phủ một lớp nhôm.
b) Một hỗn hợp đồng và nhôm được tạo thành.
c) Dung dịch trở nên xanh.
d) Không biến đổi hóa học nào xảy ra.
Do đồng hoạt động hóa học yếu hơn nhôm (aluminium) nên không đẩy được nhôm ra khỏi muối.
Vậy a – sai; b – sai; c – sai; d – đúng.
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 13. Cho các phát biểu sau:
(a) Cu2+ có tính oxi hóa mạnh hơn Fe3+ và Cu có tính khử mạnh hơn Fe2+.
(b) Zn có tính khử mạnh hơn Pb và Zn2+ có tính oxi hóa yếu hơn Pb2+.
(c) Những kim loại có thế điện cực chuẩn âm đều khử được H+ thành H2 và phản ứng được trong dung dịch HCl.
(d) Trong dãy hoạt động hóa học, những kim loại đứng trước có thế điện cực chuẩn lớn hơn thế điện cực chuẩn của những kim loại đứng sau.
(e) Kẽm có thể khử các ion Fe2+ và Ni2+ về kim loại Fe và Ni nhưng không thể khử ion Al3+ về kim loại Al.
Số phát biểu đúng là?
Đáp án đúng là: 3.
Giải thích:
Các phát biểu b, c, e đúng.
a. Sai vì Cu2+ có tính oxi hóa yếu hơn Fe3+.
d. Sai, những kim loại đứng trước có thế điện cực nhỏ hơn.
Câu 14. Cho các phản ứng sau:
(a) Zn(s) + Sn2+(aq) →
(b) Ag+(aq) + Fe(s) →
(c) Fe(s) + Mg2+(aq) →
(d) Au(s) + Cu2+(aq) →
Có bao nhiêu phản ứng tự xảy ra ở điều kiện chuẩn?
Đáp án đúng là: 2.
Giải thích:
Các phản ứng (a), (b) đây có thể tự xảy ra ở điều kiện chuẩn.
(a) Zn(s) + Sn2+(aq) → Zn2+ (aq) + Sn (s).
(b) 2Ag+(aq) + Fe(s) → Fe2+ (aq) + 2Ag (s).
Câu 15. Cho các thông tin sau:
X(s) + YSO4(aq) → không có phản ứng
Z(s) + YSO4 (aq) → Y(s) + ZSO4 (aq)
Trong đó, X, Y, Z là các kim loại. Sắp xếp các kim loại theo mức độ hoạt động của chúng giảm dần?
Đáp án đúng là: Z > Y > X.
Giải thích:
X(s) + YSO4(aq) → không có phản ứng nên X hoạt động hoá học yếu hơn Y.
Z(s) + YSO4 (aq) → Y(s) + ZSO4 (aq) nên Z hoạt động hoá học mạnh hơn Y.
Phần 2. Lý thuyết Thế điện cực chuẩn của kim loại
I. Cặp oxi hóa – khử của kim loại
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
Mn+ + ne M
M Mn+ + ne
- Trong trường hợp trên, chất oxi hóa (dạng oxi hóa) Mn+ và chất khử (dạng khử). M thuộc cùng một nguyên tố kim loại. Quá trình trên được viết gọn như sau:
Mn+ + ne M
Dạng oxi hóa Dạng khử
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại đó.
II. Thế điện cực chuẩn của kim loại
1. Thế điện cực chuẩn
- Thế điện cực của cặp oxi hóa – khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1M, nhiệt độ 25oC) được gọi là thế điện cực chuẩn của kim loại, kí hiệu là
- Đơn vị thường sử dụng của thế điện cực là volt (V)
- Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
2. Bảng thế điện cực chuẩn của kim loại và ứng dụng
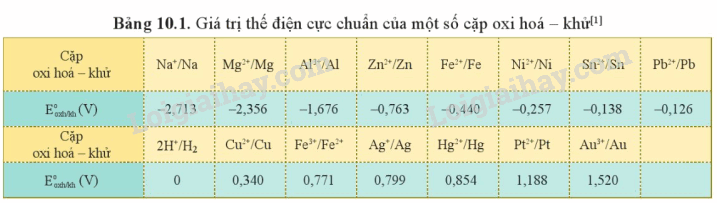
Nếu càng lớn thì
+ Tính oxi hóa của Mn+ càng mạnh.
+ Tính khử của M càng yếu

Dự đoán chiều phản ứng oxi hóa – khử
Nguyên tắc chung của phản ứng oxi hóa – khử xảy ra như sau:
- Chất oxi hóa mạnh hơn + Chất khử mạnh hơn Chất khử yếu hơn + Chất oxi hóa yếu hơn
Sơ đồ tư duy Thế điện cực chuẩn của kim loại
Xem thêm các bài Trắc nghiệm Hóa học 12 Cánh diều hay, chi tiết khác: