Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 12 Bài 15: Thế điện cực và nguồn điện hoá học sách Kết nối tri thức. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 12. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 15: Thế điện cực và nguồn điện hoá học. Mời các bạn đón xem:
Trắc nghiệm Hóa học 12 Bài 15: Thế điện cực và nguồn điện hoá học
Phần 1. Trắc nghiệm Thế điện cực và nguồn điện hoá học
Câu 1. Giá trị thế điện cực chuẩn của cặp oxi hoá − khử nào được quy ước bằng 0?
A. Na+/Na.
B. 2H+/H2.
C. Al3+/Al.
D. Cl2/2Cl–.
Đáp án đúng là: B
Cặp oxi hoá − khử có thế điện cực chuẩn bằng 0 là 2H+/H2.
Câu 2. Ở điều kiện chuẩn, kim loại nào sau đây tác dụng được với dung dịch HCl?
A. Mg.
B. Cu.
C. Hg.
D. Au.
Đáp án đúng là: A
Ở điều kiện chuẩn, kim loại Mg đứng trước H nên khử được ion H+ thành H2. Do đó Mg tác dụng được với dung dịch HCl tạo thành muối MgCl2 và giải phóng khí H2.
Câu 3. Cho pin điện hóa Pb – Cu có sức điện động chuẩn = 0,47 V, pin Zn – Cu có sức điện động chuẩn = 1,10 V. Sức điện động chuẩn của pin Zn – Pb là
A. 0,63 V.
B. 1,57 V.
C. 0,47 V.
D. 0,55 V.
Đáp án đúng là: A
Ta có: =
=
⟹ = (V).
Vậy sức điện động chuẩn của pin Zn – Pb là 0,63 V.
Câu 4. Cặp oxi hóa – khử của kim loại là
A. dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại.
B. dạng oxi hóa và dạng khử của cùng một hợp chất của kim loại.
C. dạng oxi hóa và dạng khử của các dạng thù hình của một nguyên tố kim loại.
D. dạng oxi hóa và dạng khử của một cation kim loại và kim loại đó.
Đáp án đúng là: A
Cặp oxi hóa – khử của kim loại là dạng oxi hóa và dạng khử tương ứng của một nguyên tố kim loại.
Câu 5. Trong quá trình hoạt động của pin điện Ni − Cu, quá trình xảy ra ở anode là
A. Ni ⟶ Ni2+ + 2e.
B. Cu ⟶ Cu2+ + 2e.
C. Cu2+ + 2e ⟶ Cu.
D. Ni2+ + 2e ⟶ Ni.
Đáp án đúng là: A
Trong pin điện hóa Ni − Cu thì cực âm là Ni (anode) xảy ra quá trình oxi hóa: Ni ⟶ Ni2+ + 2e.
Câu 6. Kí hiệu cặp oxi hoá − khử ứng với quá trình khử: Fe2+ + 2e → Fe là
A. Fe3+/Fe2+.
B. Fe2+/Fe.
C. Fe3+/Fe.
D. Fe2+/Fe3+.
Đáp án đúng là: B
Dạng oxi hóa Fe2+ và dạng khử Fe tạo nên cặp oxi hóa − khử Fe2+/Fe.
Câu 7. Trong số các ion: Ag+, Al3+, Na+, Mg2+, ion nào có tính oxi hoá mạnh nhất ở điều kiện chuẩn?
A. Na+.
B. Mg2+.
C. Ag+.
D. Al3+.
Đáp án đúng là: C
Theo thứ tự trong dãy điện hóa: ion đứng sau sẽ có tính oxi hóa mạnh hơn ion đứng trước nên ion có tính oxi hóa mạnh nhất là Ag+.
Câu 8. Dãy các kim loại được sắp xếp theo chiều tính khử giảm dần là
A. K > Na > Mg > Cu > Ag > Al.
B. Ba > K > Ag > Cu > Fe > Al.
C. K > Mg > Al > Fe > Cu > Ag.
D. Ca > Zn > Cu > Mg> Fe > Al.
Đáp án đúng là: C
Theo thứ tự trong dãy điện hóa, dãy các kim loại được sắp xếp theo chiều tính khử giảm dần là: K > Mg > Al > Fe > Cu > Ag.
Câu 9. Dãy các ion được sắp xếp theo chiều tính oxi hoá giảm dần là
A. K+ > Mg2+ > Al3+ > Fe2+ > Cu2+.
B. Fe2+ > Cu2+ > K+ > Mg2+ > Al3+.
C. Cu2+ > Fe2+ > K+ > Mg2+ > Al3+.
D. Cu2+ > Fe2+ > Al3+ > Mg2+ > K+.
Đáp án đúng là: D
Theo thứ tự trong dãy điện hóa, dãy các ion được sắp xếp theo chiều tính oxi hoá giảm dần là: Cu2+ > Fe2+ > Al3+ > Mg2+ > K+.
Câu 10. Cho pin điện hoá Al – Pb. Biết ; . Sức điện động của pin điện hoá Al – Pb là
A. 1,79V.
B. −1,79V.
C. −1,53V.
D. 1,53V.
Đáp án đúng là: D
= - = – 0,13 – (–1,66)= 1,53 V.
Câu 11. Pin Galvani Zn − Cu gồm điện cực kẽm và điện cực đồng được nối với nhau bởi cầu muối (thường chứa dung dịch KCl bão hòa).
a. Khi hoạt động, điện cực Zn bị tan đi.
b. Tại cực dương (cathode) xảy ra sự oxi hóa Zn.
c. Dòng electron di chuyển từ cực Zn sang cực Cu.
d. Khối lượng cực Cu tăng lên so với trước khi hoạt động.
a. Đúng.
b. Sai vì cực dương là Cu xảy ra sự khử Cu2+.
c. Đúng.
d. Đúng vì Cu được tạo ra và bám vào cực dương
Câu 12. Những phát biểu sau đây là đúng hay sai?
a. Phản ứng hóa học xảy ra trong pin Galvani là phản ứng tự diễn biến.
b. Trong pin Galvani, điện cực âm là nơi xảy ra quá trình khử.
c. Sức điện động của pin Galvani là hiệu điện thế giữa hai điện cực.
d. Pin Galvani tạo ra dòng điện từ quá trình vật lí.
a. Đúng vì phản ứng hóa học xảy ra trong pin Galvani là phản ứng oxi hóa – khử tự diễn biến.
b. Đúng.
c. Sai vì sức điện động của pin Galvani là hiệu thế điện cực chuẩn của cặp oxi hóa – khử.
d. Sai vì dòng điện từ tạo ra từ quá trình hóa học.
Câu 13. Cho pin điện hóa Zn2+/Zn và Cu2+/ Cu. Cho và . Tính sức điện động chuẩn của pin.
Đáp số: 1,1.
Giải thích:
.
Câu 14. Sức điện động chuẩn của pin Cu2+/ Cu và Ag+/ Ag là = 0,46V; Biết . Xác định thế điện cực chuẩn của cặp oxi hóa – khử Ag+/ Ag.
Đáp số: 0,8.
.
Câu 15. Tổng số phản ứng hóa học xảy ra khi lần lượt cho Fe, Ag, Zn, Al, Au vào dung dịch CuSO4 là bao nhiêu?
Dựa vào dãy điện hóa, kim loại đứng trước Cu sẽ tác dụng được với với Cu2+. Như vậy có 3 kim loại trong dãy trên thỏa mãn là: Fe, Zn, Al.
Các phương trình hóa học:
Fe + CuSO4 > FeSO4 + Cu.
Zn + CuSO4 ZnSO4 + Cu.
2Al + 3CuSO4 Al2(SO4)3 + 3Cu.
Phần 2. Lý thuyết Thế điện cực và nguồn điện hoá học
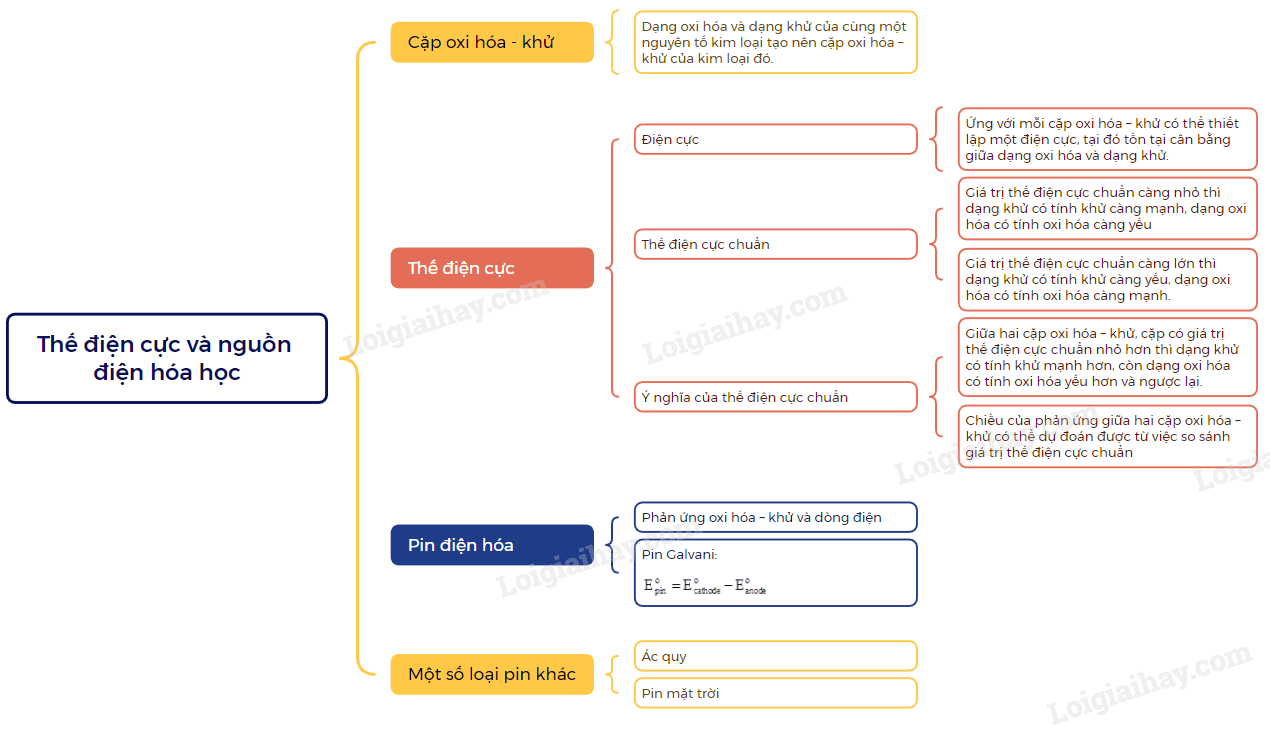
I. Cặp oxi hóa – khử
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
Mn+ + ne M
M Mn+ + ne
- Trong trường hợp trên, chất oxi hóa (dạng oxi hóa) Mn+và chất khử (dạng khử). M thuộc cùng một nguyên tố kim loại. Quá trình trên được viết gọn như sau:
Mn+ + ne M
Dạng oxi hóa Dạng khử
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại đó.
II. Thế điện cực chuẩn
1. Điện cực
Ứng với mỗi cặp oxi hóa – khử có thể thiết lập một điện cực, tại đó tồn tại cân bằng giữa dạng oxi hóa và dạng khử.
2. Thế điện cực chuẩn
Thế điện cực của cặp oxi hóa – khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1M, nhiệt độ 25oC) được gọi là thế điện cực chuẩn của kim loại, kí hiệu là
Đơn vị thường sử dụng của thế điện cực là volt (V)
- Giá trị thế điện cực chuẩn càng nhỏ thì dạng khử có tính khử càng mạnh, dạng oxi hóa có tính oxi hóa càng yếu
- Giá trị thế điện cực chuẩn càng lớn thì dạng khử có tính khử càng yếu, dạng oxi hóa có tính oxi hóa càng mạnh.
3. Ý nghĩa của thế điện cực chuẩn
a) So sánh tính khử, tính oxi hóa giữa các cặp oxi hóa – khử
Giữa hai cặp oxi hóa – khử, cặp có giá trị thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn, còn dạng oxi hóa có tính oxi hóa yếu hơn và ngược lại.
Trên cơ sở so sánh giá trị thế điện cực chuẩn, các cặp oxi hóa – khử Mn+/M được sắp xếp thành dãy theo chiều tăng dần thế điện cực chuẩn, thường gọi là dãy điện hóa của kim loại
b) Dự đoán chiều phản ứng giữa hai cặp oxi hóa – khử
- Chiều của phản ứng giữa hai cặp oxi hóa – khử có thể dự đoán được từ việc so sánh giá trị thế điện cực chuẩn
- Chất khử của cặp oxi hóa – khử có thế điện cực nhỏ hơn tác dụng với chất oxi hóa cặp oxi hóa – khử có thế điện cực lớn hơn, tạo ra dạng oxi hóa và dạng khử tương ứng
- Chất khử của cặp oxi hóa – khử đứng trước tác dụng với chất oxi hóa của cặp oxi hóa – khử đứng sau, tạo ra dạng oxi hóa và dạng khử tương ứng.
Hai cách dự đoán trên được minh họa thông qua quy tắc
III. Pin điện hóa
1. Phản ứng oxi hóa – khử và dòng điện
Phản ứng oxi hóa – khử luôn kèm theo sự chuyển electron từ chất khử sang chất oxi hóa. Nếu các quá trình oxi hóa, quá trình lhử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hóa qua dây dẫn thì năng lượng của phản ứng hóa học sẽ chuyển thành năng lượng điện.
2. Pin Galvani
- Pin Galvani là pin điện hóa có cấu tạo gồm hai điện cực, mỗi điện cực ứng với một cặp oxi hóa – khử và thường nối với nhau qua cầu muối.
- Sức điện động của pin đo ở điều kiện chuẩn gọi là sức điện động chuẩn. Sức điện động chuẩn có thể xác định dựa vào thế điện cực chuẩn của các cặp oxi hóa – khử tương ứng:
IV. Một số loại pin khác
Acquy là nguồn điện được sử dụng phổ biến trong các phương tiện giao thông, thiết bị lưu điện, phát điện.
- Pin nhiên liệu: hoạt động dựa trên phản ứng oxi hóa – khử giữa nhiên liệu và chất oxi hóa. Pin nhiên liệu phổ biến hiện nay là pin hydrogen. Ưu điểm của pin nhiên liệu là nhiên liệu được bổ sung liên tục nên thời gian hoạt động của pin không bị hạn chế. Nhược điểm của pin nhiên liệu là công nghiệp chưa được phổ biến và giá thành cao.
- Pin mặt trời bao gồm nhiều tế bào quang điện làm biến đổi năng lượng ánh sáng thành năng lượng điện. Ưu điểm tạo được nguồn năng lượng xanh, thân thiện với môi trường, chi phí không quá cao, sử dụng lâu dài tuy nhiên, pin mặt trời cần được lắp đặt trên không gian rộng để pin tiếp xúc trực tiếp với ánh sáng mặt trời. Loại pin này khó di chuyển.
Sơ đồ tư duy Thế điện cực và nguồn điện hoá học
Xem thêm các bài Trắc nghiệm Hóa học 12 Kết nối tri thức hay, chi tiết khác: