Tailieumoi.vn giới thiệu Giải bài tập Hóa Học lớp 11 Bài 20: Mở đầu về hoá học hữu cơ chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Mở đầu về hoá học hữu cơ lớp 11.
Giải bài tập Hóa Học lớp 11 Bài 20: Mở đầu về hoá học hữu cơ
Câu hỏi và bài tập (trang 91sgk Hóa học 11)
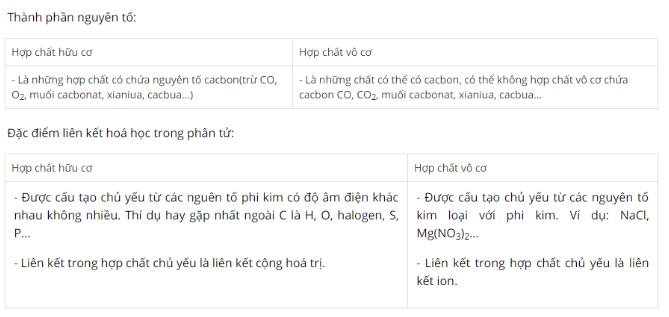
Bài 1 trang 91 sgk hóa học 11: So sánh hợp chất vô cơ và hợp chất hữu cơ về: thành phần nguyên tố, đặc điểm liên kết hoá học trong phân tử.
Lời giải:
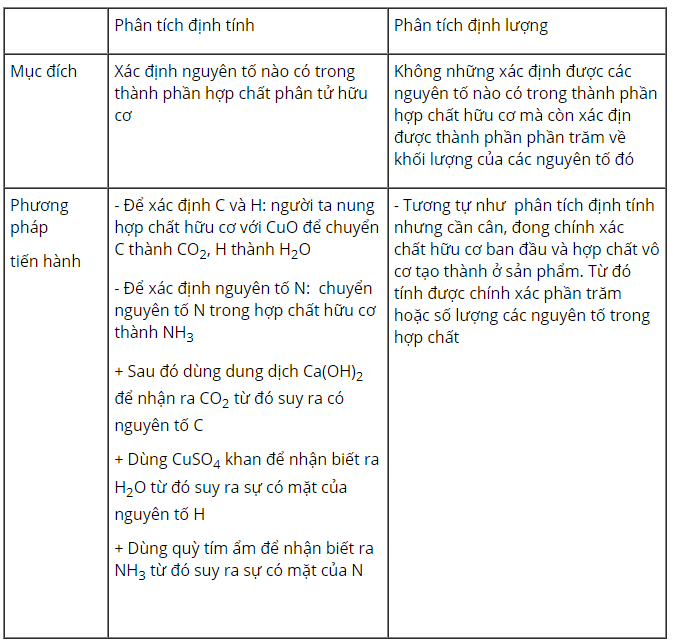
Bài 2 trang 91 sgk hóa học 11: Nếu mục đích và phương pháp tiến hành phân tích định tính và định lượng nguyên tố.
Bài 3 trang 91 sgk hóa học 11: Oxi hoá hoàn toàn 0,6 gam hợp chất hữu cơ A thu được 0,672 lít CO2 (đktc) và 0,72 gam H2O. Tính thành phần phần trăm khối lượng của các nguyên tố trong phân tử chất A.
Tính nCO2 = mCO2/ 44 = ? (mol) => mC
Tính nH2O = mH2O/ 18 = ? (mol) => => mH
% C = ( mC / mA).100% = ?
% H = ( mH / mA). 100% = ?
% O = 100% - % C - % H

Bài 4 trang 91 sgk hóa học 11: β-Caroten (chất hữu cơ có trong củ cà rốt) có màu da cam. Nhờ tác dụng của enzim ruột non, β-Croten chuyển thành vitamin A nên nó còn được gọi là tiền vitamin A. Oxi hoá hoàn toàn 0,67 gam β-Caroten rồi dẫn sản phẩm oxi hoá qua bình (1) đựng dung dịch H2SO4 đặc, sau đó qua bình (2) đựng dung dịch Ca(OH)2 dư. Kết quả cho thấy khối lượng bình (1) tăng 0,63 gam; bình (2) có 5 gam kết tủa. Tính phần trăm khối lượng của các nguyên tố trong phân tử β-Caroten
Khối lượng bình 1 tăng chính là khối lượng của H2O => nH2O = 0,63/ 18 = ? (mol) => mH = ?
Bảo toàn nguyên tố C: nCO2 = nCaCO3 = 5/100 = ? (mol) => mC = ?
Lời giải:
Sản phẩm oxi hoá qua bình (1) đựng dung dịch H2SO4 đặc làm khối lượng bình (1) tăng 0,63 g chính là lượng nước bị giữ lại => mH = x 2 = 0,07 g.
Qua bình (2) chứa dung dịch Ca(OH)2 dư, làm cho bình xuất hiện kết tủa chính là do lượng CO2 bị giữ lại vì tham gia phản ứng sau:
Ca(OH)2 + CO2 → CaCO3 + H2O
0,05 ← = 0,05 mol
=> mC = 0,05 x 12 = 0,6 (g).
=> mO = 0,67 - (mC + mH) = 0
Từ đó tính được %mC = 89,55%; %mH = 10,45%
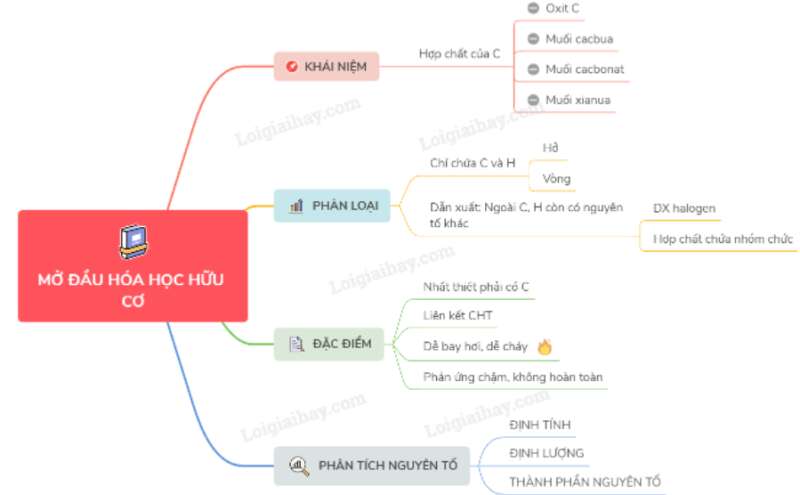
- Hoá học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ.
II. PHÂN LOẠI HỢP CHẤT HỮU CƠ
Hợp chất hữu cơ được chia thành hidrcacbon và dẫn xuất hidrcacbon.
1. Hidrocacbon là loại hợp chất hữu cơ đơn giản nhất, trong thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hidro.
- Hidrocacbon mạch hở:
+ Hidrocacbon no: Ankan
+ Hidrocacbon không no có một nối đôi: Anken
+ Hidrocacbon không no có hai nối đôi: Ankadien
- Hidrocacbon mạch vòng:
+ Hidrocacbon no: xicloankan
+ Hidrocacbon mạch vòng: Aren
2. Dẫn xuất của hidrocacbon là những hợp chất mà trong phân tử ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen...
- Dẫn xuất halogen: R – X ( R là gốc hidrocacbon)
- Hợp chất chứa nhóm chức:
- OH - : ancol; - O - : ete; - COOH: axit......
III. ĐẶC ĐIỂM CHUNG
- Hợp chất hữu cơ nhất thiết phải chứa C, hay có H thường gặp O ngoài ra còn có halogen, N, P...
- Liên kết chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
- Các hợp chất hữu cơ thường dễ bay hơi, dễ cháy, kém bền nhiệt.
- Các phản ứng trong hoá học hữu cơ thường chậm, không hoàn toàn, xảy ra theo nhiều hướng thường phải đun nóng và có xúc tác.
Để xác định công thức phân tử hợp chất hữu cơ người ta phải xác định :
- Thành phần định tính nguyên tố.
- Thành phần định lượng nguyên tố.
- Xác định khối lượng phân tử.
1. Phân tích định tính nguyên tố.
- Phân tích định tính nguyên tố để xác định thành phần các nguyên tố hóa học chứa trong một chất.
2. Phân tích định lượng các nguyên tố:
- Phân tích định lượng các nguyên tố xác định khối lượng của mỗi nguyên tố hóa học chứa trong hợp chất hữu cơ.
- Muốn định lượng nguyên tố, người ta chuyển các nguyên tố trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản, định lượng chúng, từ đó suy ra khối lượng từng nguyên tố có trong một chất.
3. Thành phần nguyên tố:
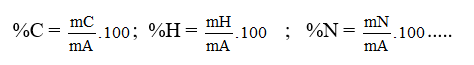
Sơ đồ tư duy: Mở đầu về hoá học hữu cơ