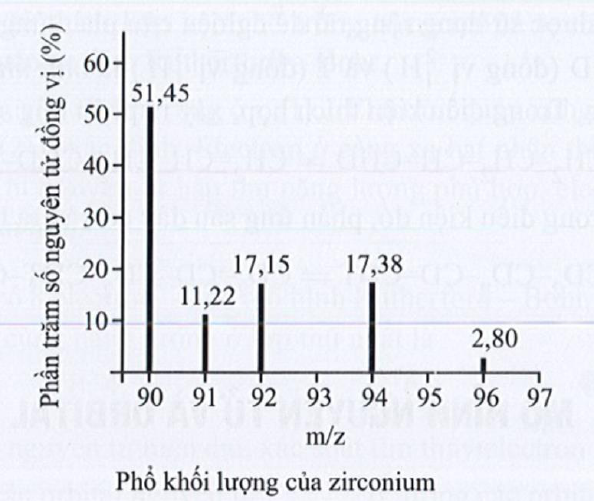
Câu 20: Nguyên tử R tạo được Anion R
2-
. Cấu hình e của R
2-
ở trạng thái cơ bản là 3p
6
. Tổng số hạt mang
điện trong R là.
A. 18 B. 32 C. 38 D. 16
Câu 21: Anion X
-
và cation Y
2+
đều có cấu hình electron lớp ngoài cùng là 3s
2
3p
6
. Vị trí của các nguyên
tố trong bảng tuần hoàn các nguyên tố hóa học là:
A.
X có số thứ tự 17, chu kỳ 3, nhóm VIIA; Y có số thứ tự 20, chu kỳ 4, nhóm IIA .
B.
X có số thứ tự 18, chu kỳ 3, nhóm VIIA; Y có số thứ tự 20, chu kỳ 3, nhóm IIA .
C.
X có số thứ tự 17, chu kỳ 4, nhóm; Y có số thứ tự 20, chu kỳ 4, nhóm IIA .
D.
X có số thứ tự 18, chu kỳ 3, nhóm VIA; Y có số thứ tự 20, chu kỳ 4, nhóm IIA .
Câu 22: Những tính chất nào sau đây không biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt
nhân nguyên tử ?
A. Số electron lớp ngoài cùng B. Độ âm điện của các nguyên tố
C. Khối lượng nguyên tử D. Tính kim loại, tính phi kim .
Câu 23: Trong chu kì, từ trái sang phải, theo chiều điện tích hạt nhân tăng dần
A. Tính kim loại tăng, tính phi kim giảm B. Tính kim loại giảm, tính phi kim tăng
C. Tính kim loại tăng, tính phi kim tăng D. Tính kim loại giảm, tính phi kim giảm
Câu 24: Trong nhóm, từ trên xuống dưới, theo chiều điện tích hạt nhân tăng dần
A. Bán kính nguyên tử tăng, độ âm điện giảm B. Bán kính nguyên tử giảm, độ âm điện tăng
C. Bán kính nguyên tử tăng, độ âm điện tăng D. Bán kính nguyên tử giảm, độ âm điện giảm
Câu 25: Trong nhóm, từ trên xuống dưới, theo chiều điện tích hạt nhân tăng dần
A.
Tính bazơ của oxit và hidroxit tăng, tính axit của oxit và hiđroxit tăng
B.
Tính bazơ của oxit và hidroxit giảm, tính axit của oxit và hidroxit giảm
C.
Tính bazơ của oxit và hidroxit tăng, tính axit của oxit và hidroxit giảm
D.
Tính bazơ của oxit và hidroxit giảm, tính axit của oxit và hidroxit tăng
Câu 26: Cấu hình electron nguyên tử của 3 nguyên tố X, Y, Z lần lượt là: 1s
2
2s
2
2p
6
3s
1
, 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
, 1s
2
2s
2
2p
6
3s
2
3p
1
. Nếu xếp theo chiều tăng dần tính kim loại thì sự sắp xếp đúng là
A. Z < X < Y B. Z < Y < X C. Y < Z < X D. X < Y < Z
Câu 27: Các nguyên tố:
12
Mg,
13
Al,
5
B,
6
C được xếp theo thứ tự tăng dần độ âm điện là:
A. Mg < B < Al < C. B. Mg < Al < B <C. C. B < Mg < Al <C. D. Al < B < Mg <C.
Câu 28: Các nguyên tố sau :
3
Li;
6
C;
10
Ne;
11
Na. Cách sắp xếp nào sau đây đúng theo trật tự tăng dần bán
kính nguyên tử?
A. Ne, Na, C, Li B. Li, Na, C, Ne C. Ne, C, Li, Na D. C, Na, Li, Ne
Câu 29: Dãy chất nào sau đây được sắp xếp đúng theo thứ tự tính axit giảm dần (
14
Si,
15
P,
16
S,
17
Cl)
A. H
2
SiO
3
, H
3
PO
4
, H
2
SO
4
, HClO
4
. B. HClO
4
, H
3
PO
4
, H
2
SO
4
, H
2
SiO
3
.
C. HClO
4
, H
2
SO
4
, H
3
PO
4
, H
2
SiO
3
. D. H
2
SO
4
, HClO
4
, H
3
PO
4
, H
2
SiO
3
.