Tailieumoi.vn giới thiệu giải bài tập Chuyên đề Hóa học 10 Bài 7: Hóa học về phản ứng cháy, nổ sách Kết nối tri thức hay, chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập Chuyên đề học tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Chuyên đề Hóa học 10 Bài 7: Hóa học về phản ứng cháy, nổ
Giải Chuyên đề Hóa học 10 trang 38
A/ Câu hỏi đầu bài
Lời giải:
- Hiệu ứng nhiệt của phản ứng đốt cháy được xác định qua sự biến thiên enthalpy.
- Cách tính:
+ Tính thông qua nhiệt tạo thành:
+ Tính theo năng lượng liên kết:
- Phản ứng cháy, nổ kèm theo sự giải phóng năng lượng lớn và tốc độ phản ứng nhanh.
Giải Chuyên đề Hóa học 10 trang 40
B/ Câu hỏi giữa bài
I. Biến thiên enthalpy của một số phản ứng cháy, nổ
Câu hỏi 1 trang 40 Chuyên đề Hóa 10: Xét phản ứng:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) = – 802 kJ
Tính của CH4(g), biết của CO2(g) và H2O(g) lần lượt là – 394 kJ/mol và – 242 kJ/mol.
Lời giải:
Ta có:
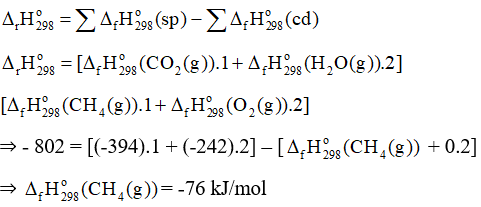
Giả thiết toàn bộ nhiệt lượng tỏa ra được tính từ biến thiên enthalpy của phản ứng đốt cháy glucose:
C6H10O5(s) + 5O2(g) ⟶ 6CO2(g) + 5H2O(l) = -2 880 kJ
Lời giải:
Đốt cháy 1 mol glucose sẽ tỏa ra nhiệt lượng là 2 880 kJ.
⇒ Đốt cháy 0,162 kg glucose sẽ tỏa ra nhiệt lượng là 2 880 kJ.
Do củi khô chứa 54% khối lượng cellulose và phân tử cellulose được cấu tạo bởi các gốc glucose.
⇒ Đốt cháy củi khô sẽ tỏa ra nhiệt lượng là 2 880 kJ.
Vậy đốt cháy 1 kg sẽ tỏa ra nhiệt lượng là kJ.
2NH4NO3(s) 2N2(g) + O2(g) + 4H2O(g)
a) Tính của phản ứng, biết của NH4NO3(s) và của H2O(g) lần lượt là –365, 6 kJ/mol và –242 kJ/mol.
b) Tính nhiệt lượng tối đa giải phóng ra từ vụ nổ khi toàn bộ lượng NH4NO3 bị phân huỷ.
Lời giải:
a) Tổng nhiệt tạo thành chất đầu là:
= -365,6.2 = - 731,2 kJ
Tổng nhiệt tạo thành các chất sản phẩm là:
= 0.2 + 0.1 + (-242).4 = - 968 kJ
Biến thiên enthalpy của phản ứng:
= - 968 - (-731,2) = - 236,8 kJ
b) Ta có: 2700 tấn NH4NO3 = mol = 3375.104 mol NH4NO3.
Nhiệt lượng tỏa ra khi nổ 1 mol NH4NO3 là 236,8 kJ.
⇒ Nhiệt lượng tỏa ra khi nổ 3375.104 mol NH4NO3 là = 79,92.108 kJ.
Giải Chuyên đề Hóa học 10 trang 42
II. Tốc độ phản ứng cháy và tốc độ “phản ứng hô hấp”
Hỏi tại thời điểm có người đến cứu, tốc độ “phản ứng hô hấp" của người trong xe giảm bao nhiêu lần so với bình thường? Giả thiết vhô hấp = .
Lời giải:
Tốc độ “phản ứng hô hấp” giảm so với điều kiện bình thường là:
lần
Lời giải:
Chú ý:
- Ở điều kiện thường, oxygen chiếm 21% thể tích không khí và có áp suất 0,21 atm.
- Nồng độ oxygen tỉ lệ với áp suất.
⇒ Tốc độ “phản ứng hô hấp” giảm so với điều kiện bình thường là:
lần
• Duy trì không gian thông thoáng đề đảm bảo lượng oxygen cho cơ thể.
Lời giải:
- Công thức tính hiệu ứng nhiệt của phản ứng cháy, nổ:
+ Dựa vào nhiệt hình thành của các chất
+ Dựa vào năng lượng liên kết
- Phản ứng cháy, nổ kèm theo sự giải phóng năng lượng lớn và tốc độ phản ứng nhanh.
- Để duy trì không gian thông thoáng để đảm bảo lượng oxygen cho cơ thể cần:
+ Tạo không gian sống thoáng mát, sạch sẽ
+ Không để cây to trong phòng ngủ, phòng kín.
+ Trồng nhiều cây xanh quanh nhà.