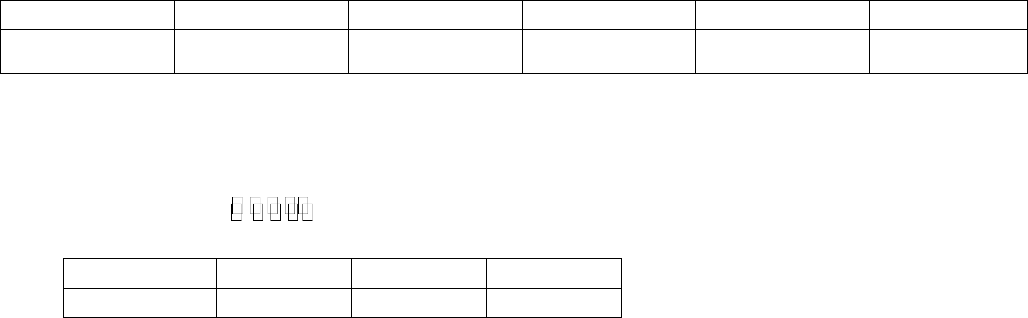
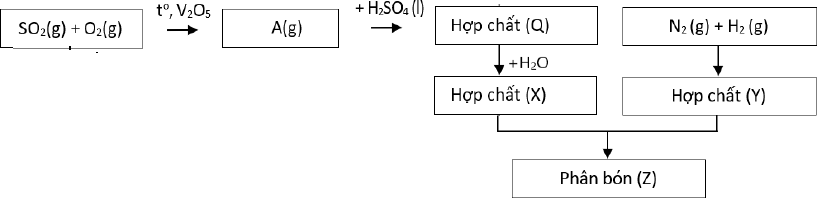
Câu 16: Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất phân bón (Z). Hãy xác định
các chất (A), (Q), (X), (Y), (Z). Viết các phản ứng hóa học xảy ra.
Câu 17: Nhiều hộ gia đình thường trữ một số hóa chất như baking soda (NaHCO
3
), thạch cao nung
(CaSO
4
.0,5H
2
O) và phèn chua (hay phèn nhôm kali, K
2
SO
4
.Al
2
(SO
4
)
3
.24H
2
O hay KAl(SO
4
)
2
.12H
2
O).
a)
Hãy tìm hiểu các ứng dụng của mỗi hóa chất trên tại các hộ gia đình.
b)
Có thể dùng nước và quỳ tím để phân biệt các mẫu bột mịn của ba chất trên không? Giải thích.
Câu 18: Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành
1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ mỗi 10,0 mL dung dịch acid này bằng dung dịch
NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Hãy xác định công thức
của oleum trên.
Câu 19: Trong công nghiệp, chất rắn copper(II) sulfate pentahydrate có thể được sản xuất từ copper(II)
???? ?ị ?ℎ ?2??4 ??ã?? ?ế? ???ℎ
oxide theo hai giai đoạn của quá trình: CuO (s) → CuSO
4
(aq) → CuSO
4
.5H
2
O
a) Từ 1 tấn nguyên liệu chứa 96% copper(II) oxide theo khối lượng (còn lại là tạp chất trơ) sẽ thu được
bao nhiêu kilôgam copper(II) sulfate pentahydrate rắn? Cho hiệu suất của quá trình là 85%.
b) Một ao nuôi thuỷ sản có diện tích bề mặt nước là 2 000 m
2
, độ sâu trung bình của nước trong ao là 0,7
m đang có hiện tượng phú dưỡng. Để xử lí tảo xanh có trong ao, người dân cho copper(II) sulfate
pentahydrate vào ao trong 3 ngày, mỗi ngày một lần, mỗi lần là 0,25 g cho 1 m
3
nước trong ao. Hãy cho
biết tổng khối lượng (kg) copper(II) sulfate pentahydrate người dân cần sử dụng.
Câu 20: Hòa tan 3,92 gam một muối X ngậm nước vào cốc nước, thu được 100 ml dung dịch X gồm các ion:
Fe
2+
, NH
+
và SO
2-
. Cho dung dịch NaOH dư vào 20 ml dung dịch X, đun nóng, thu được 49,58 ml khí (đkc).
4 4
Cho dung dịch BaCl
2
dư vào 20 ml dung dịch X, thu được 0,466 gam kết tủa. Xác định công thức của X.
2.
Trắc nghiệm
Câu 21: Khí nào phổ biến nhất trong khí quyển Trái Đất?
A. Oxygen. B. Nitrogen. C. Ozone. D. Argon.
Câu 22: Công thức hoá học của diêm tiêu Chile là
A. Ca(NO
3
)
2
. B. NH
4
NO
3
. C. NH
4
Cl. D. NaNO
3
.
Câu 23: Vị trí (chu kì, nhóm) của nguyên tố nitrogen trong bảng tuần hoàn là
A. chu kì 2, nhóm VA. B. chu kì 3, nhóm VA.
C. chu kì 2, nhóm VIA. D. chu kì 3, nhóm IVA.
Câu 24: Trong tự nhiên, nguyên tố nitrogen tồn tại trong hợp chất hữu cơ nào sau đây?
A. Tinh bột. B. Cellulose. C. Protein. D. Glucose.
Câu 25: Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là
A. 0 và +5. B. -3 và 0. C. -3 và +5. D. -2 và +4.
Câu 26: Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là
A. chất khử. B. chất oxi hoá. C. acid. D. base.
Câu 27: Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành
A. NO. B. N
2
O. C. NH
3
. D. NO
2
.
Câu 28: Trong phản ứng hoá hợp với oxygen, nitrogen đóng vai trò là
A. chất oxi hoá. B. base. C. chất khử. D. acid.
Câu 29: Trong tự nhiên, phản ứng giữa nitrogen và oxygen (trong cơn mưa dông kèm sấm sét) là khởi
đầu cho quá trình tạo và cung cấp loại phân bón nào cho cây?
A. Phân kali. B. Phân lân. C. Phân đạm nitrate. D. Phân đạm ammonium.
Câu 30: Áp suất riêng phần của khí nitrogen trong khí quyển là
A. 0,21 bar. B. 0,01 bar. C. 0,78 bar. D. 0,28 bar.
Câu 31: Trong tự nhiên, nguyên tố nitrogen có hai đồng vị bền là
14
N (99,63%) và
15
N (0,37%).
Nguyên tử khối trung bình của nitrogen là
A. 14,000. B. 14,004. C. 14,037. D. 14,063.