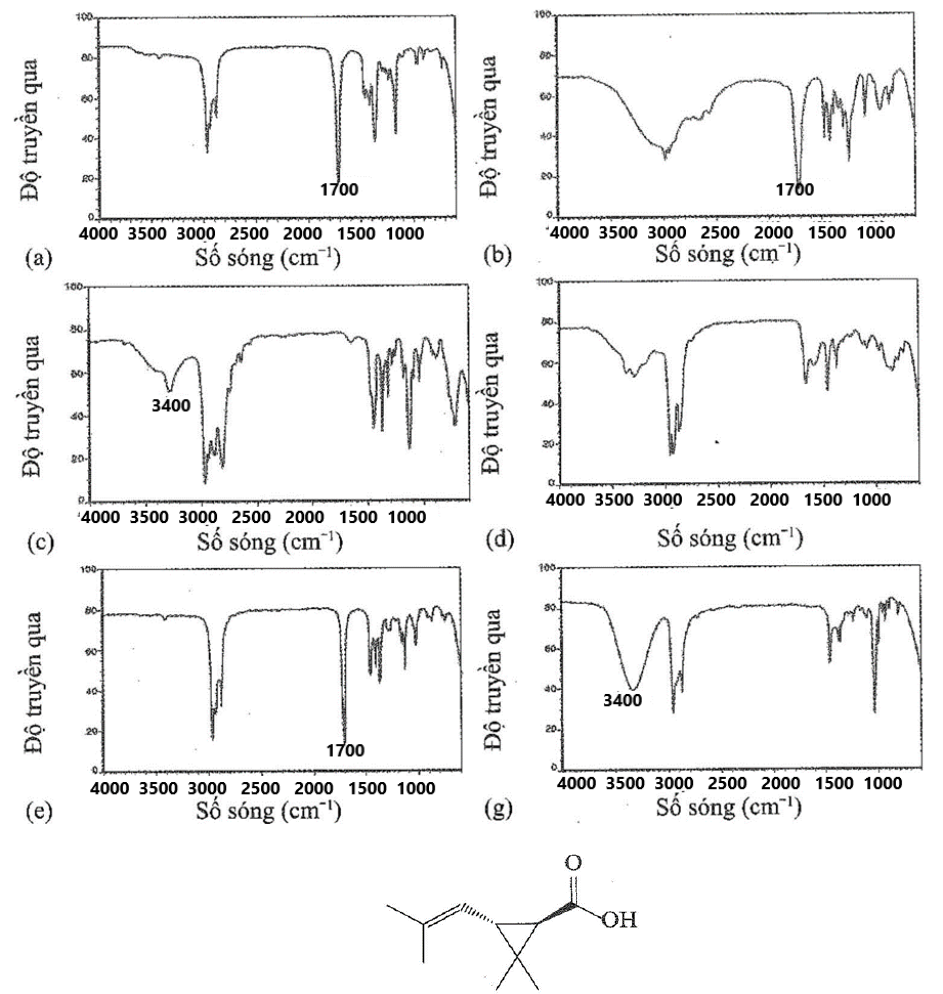
,
H
2
O
Câu 37: Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thủy phân, còn cation
kim loại trung bình và yếu bị thủy phân tạo môi trường acid, gốc acid yếu bị thủy phân tạo môi trường
base.
a) Dung dịch nào sau đây có pH > 7?
A. KNO
3
. B. AgNO
3
. C. Na
2
CO
3
. D. NaCl.
b) Dung dịch nào sau đây có pH < 7?
A. CaCl
2
. B. K
2
SO
4
. C. Na
2
S. D. Al(NO
3
)
3
.
Câu 38: Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng)?
A. CH
3
COOH, HCl và BaCl
2
B. NaOH, Na
2
CO
3
và Na
2
SO
3
C. H
2
SO
4
, NaHCO
3
và AlCl
3
D. NaHSO
4
, HCl và AlCl
3
Câu 39: pH của dung dịch nào sau đây có giá trị nhỏ nhất?
A. Dung dịch HCl 0,1 M. B. Dung dịch CH
3
COOH 0,1 M.
C. Dung dịch NaCl 0,1 M. D. Dung dịch NaOH 0,01 M.
Câu 40: Tại điểm tương đương, giá trị pH của quá trình chuẩn độ dung dịch NaOH bằng dung dịch
HCl 0,1 M là
A. 7 B. 1 C. 14 D. 13
Câu 41: Trong dung dịch trung hòa về điện, tổng đại số điện tích của các ion bằng không. Dung dịch A
có chứa 0,01 mol Mg
2+
; 0,01 mol Na
+
, 0,02 mol Cl
-
và x mol
. Giá trị của x là
A. 0,01. B. 0,02. C. 0,05. D. 0,005.
Câu 42: Đối với dung dịch acid yếu CH
3
COOH 0,10M nếu bỏ qua sự điện li của nước thì đánh giá nào
về nồng độ mol ion sau đây là đúng?
A. [H
+
]=0,10M B. [H
+
]<[CH
3
COO
–
] C. [H
+
]>[CH
3
COO
–
] D. [H
+
]<0,10
Câu 43: Có 4 dung dịch: Natri clorua, rượu etylic (C
2
H
5
OH), Acid axetic (CH
3
COOH), kali sunfat đều
có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự
sau:
A. NaCl < C
2
H
5
OH < CH
3
COOH < K
2
SO
4
. B. C
2
H
5
OH < CH
3
COOH < NaCl < K
2
SO
4
.
C. C
2
H
5
OH < CH
3
COOH < K
2
SO
4
< NaCl. D. CH
3
COOH < NaCl < C
2
H
5
OH < K
2
SO
4
.
Câu 44: Chọn phát biểu đúng trong số các phát biểu sau đây?
A. Giá trị pH tăng thì độ acid tăng. B. Dung dịch có pH>7 làm quỳ tím hóa đỏ.
C. Dung dịch có pH<7 làm quỳ tím hóa xanh. D. Giá trị pH tăng thì độ acid giảm.
Câu 45: Dung dịch nào sau đây có nồng độ ion H
+
thấp nhất?
A. Cà phê đen pH=5 B. Máu pH=7,4
C. Thuốc tẩy dầu pH=11 D. Nước chanh pH=2
Câu 46: Đo pH của một cốc nước C sủi được giá trị pH bằng 3. Nhận định nào sau đây không đúng?
A. Dung dịch có môi trường acid.
B. Nồng độ ion [H
+
] trong cốc nước lớn hơn nồng độ [OH
-
]
C. Nồng độ ion [H
+
] của dung dịch trong cốc là 0,003 mol/L
D. Nồng độ của ion [OH
-
] trong cốc nước là 10
-11
mol/L.
Câu 47: Tại khu vực bị ô nhiễm, pH của nước mưa đo được là 4,5 còn pH của nước mưa tại khu vực
không bị ô nhiễm là 6,5. Nhận xét nào sau đây không đúng?
A. Nồng độ ion H
+
trong dung dịch nước mưa bị ô nhiễm là 10
-6,5
.
B. Nồng độ ion H
+
trong dung dịch nước mưa không bị ô nhiễm là 10
-4,5
.
C. Nồng độ ion H
+
trong nước mưa bị ô nhiễm cao gấp 2 lần nồng độ ion H
+
trong nước không bị ô nhiễm
D. Nồng độ ion OH
-
trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
Câu 48: A là dung dịch HNO
3
0,01M; B là dung dịch H
2
SO
4
0,005M. Trộn các thể tích bằng nhau của
A và B được dung dịch X. pH của dung dịch X là
A. 1 B. 2 C. 3 D. 4
Câu 49: Cho 15 ml dung dịch HNO
3
có pH = 2 trung hòa hết 10 ml dung dịch Ba(OH)
2
có pH = a. Giá
trị của a là
A. 13 B. 12,4 C. 12,2 D. 12,5
Câu 50: Cho 100 ml dung dịch gồm Ba(OH)
2
0,1M và NaOH 0,1M với V ml dung dịch gồm H
2
SO
4
0,0375M và HCl 0,0125M thu được dung dịch có pH = 2 . Giá trị V là
A. 300 B. 400 C. 100 D. 600