Với tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Bài 2: Nguyên tử sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 7.
Khoa học tự nhiên lớp 7 Bài 2: Nguyên tử
Video giải KHTN 7 Bài 2: Nguyên tử - Kết nối tri thức
A. Lý thuyết KHTN 7 Bài 2: Nguyên tử
I. Quan niệm ban đầu về nguyên tử
- Theo Đê – mô – crit: sự tồn tại của một loại hạt vô cùng nhỏ (được gọi là nguyên tử) tạo nên sự đa dạng của vạn vật. Khởi nguồn của quan niệm nguyên tử là sự chia nhỏ một vật sẽ đến một giới hạn “không thể phân chia được”.
- Theo Đan – tơn: Có các đơn vị chất tối thiểu (được gọi là nguyên tử) để các chất tác dụng vừa đủ với nhau theo các lượng xác định.
II. Mô hình nguyên tử của Rơ-dơ-pho – Bo
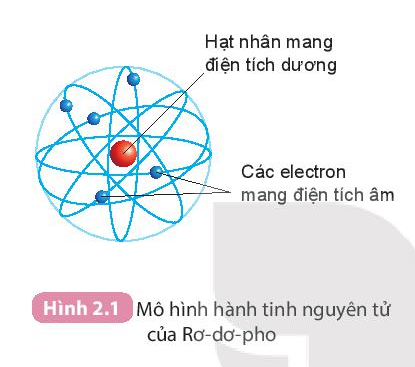
- Rơ-dơ-pho (E.Rutherford) (1871 – 1937), nhà vật lí người Niu-di-lân (New ZeaLand) đã đề xuất mô hình nguyên tử như sau:
+ Nguyên tử có cấu tạo rỗng.
+ Nguyên tử gồm: Hạt nhân ở tâm mang điện tích dương và các electron mang điện tích âm.
+ Các electron chuyển động xung quanh hạt nhân như các hành tinh quay xung quanh Mặt Trời.
- Bo (N. Bohr) (1885 – 1962), nhà vật lí người Đan Mạch, đã hoàn thiện mô hình nguyên tử của Rơ-dơ-pho như sau:
+ Các electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau.
+ Lớp electron trong cùng chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất.
+ Các lớp electron khác chứa tối đa 8 electron hoặc nhiều hơn và bị hạt nhân hút yếu hơn.
Ví dụ:
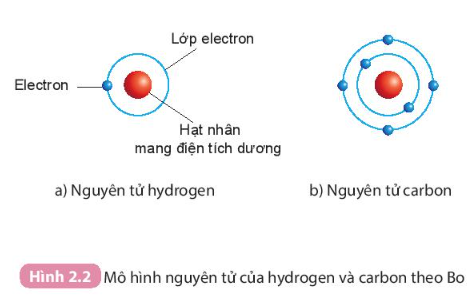
Theo mô hình nguyên tử của Bo
- Nguyên tử carbon gồm:
+ Hạt nhân ở tâm mang điện tích dương.
+ Có 6 electron chuyển động xung quanh hạt nhân và được sắp xếp thành hai lớp:
Lớp thứ nhất (lớp trong cùng gần hạt nhân nhất) có 2 electron.
Lớp thứ hai có 4 electron.
Mở rộng: Lịch sử tìm ra các hạt tạo nên nguyên tử
- Bằng các thí nghiệm vật lí, Tôm-xơn (J.J.Thomson) (1856-1940), nhà vật lí người Anh, đã xác định được electron, kí hiệu là e, là một thành phần tạo nên nguyên tử và mang điện tích âm.
- Qua thí nghiệm bắn phá lá vàng, Rơ-dơ-pho đã xác định được nguyên tử có cấu tạo rỗng và có hạt nhân ở tâm.
- Bằng cách bắn phá các hạt nhân nguyên tử, Rơ-dơ-pho đã tìm ra hạt proton mang điện tích dương và Chat-uých (J.Chadwick) đã tìm ra hạt neutron không mang điện, đó là các hạt tạo nên hạt nhân nguyên tử.
III. Cấu tạo nguyên tử
1. Hạt nhân nguyên tử
- Nguyên tử có kích thước vô cùng nhỏ, chỉ khoảng một phần mười tỉ mét. Kích thước của hạt nhân còn nhỏ hơn nữa và chỉ bằng khoảng một phần mười ngàn kích thước của nguyên tử.
- Hạt nhân nguyên tử được tạo thành từ các hạt proton và neutron.
+ Hạt proton kí hiệu là p. Mỗi hạt proton mang một đơn vị điện tích dương, quy ước là +1.
+ Hạt neutron khí hiệu n. Hạt neutron không mang điện.
- Số đơn vị điện tích hạt nhân, kí hiệu là Z, bằng tổng số proton có trong hạt nhân.
Ví dụ:
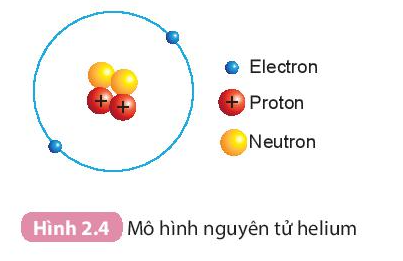
- Hạt nhân nguyên tử helium có 2p, 2n.
- Helium có 2 proton trong hạt nhân ⇒ Số đơn vị điện tích hạt nhân của helium bằng 2.
2. Vỏ nguyên tử
- Vỏ nguyên tử được cấu tạo nên bởi các electron, kí hiệu là e.
- Mỗi electron mang một đơn vị điện tích âm, quy ước là -1.
- Các electron được sắp xếp thành từng lớp:
+ Lớp thứ nhất (trong cùng, gần hạt nhân nhất) có tối đa 2 electron;
+ Lớp thứ hai có tối đa 8 electron…
- Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
- Các electron lớp ngoài cùng quyết định tính chất hóa học của nguyên tử.
Ví dụ:
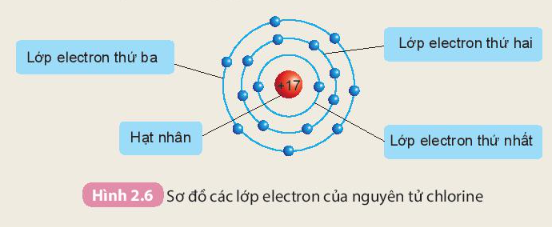
Nguyên tử chlorine có 17 electron
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài cho đến hết:
+ Lớp electron thứ nhất ở trong cùng, gần hạt nhân nhất có 2 electron.
+ Lớp electron thứ hai ở bên ngoài lớp thứ nhất có 8 electron.
+ Lớp electron thứ ba ở ngoài cùng có 7 electron.
Kết luận:
- Nguyên tử là hạt vô cùng nhỏ tạo nên các chất.
- Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm.
- Nguyên tử trung hòa và điện nên tổng số hạt proton bằng tổng số hạt electron.
IV. Khối lượng nguyên tử
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân và các hạt electron ở vỏ nguyên tử.
- Khối lượng nguyên tử vô cùng nhỏ, để thuận tiện cho việc sử dụng, người ta dùng đơn vị khối lượng nguyên tử, viết tắt là amu.
- Khối lượng 1 proton ≈ khối lượng 1 neutron ≈ 1 amu.
Khối lượng 1 electron ≈ 0,00055 amu nhỏ hơn rất nhiều so với khối lượng của proton và neutron.
⇒ Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
Ví dụ: Nguyên tử đồng có 29 proton, 29 electron, 35 neutron
Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
⇒ Khối lượng của nguyên tử đồng là 29.1amu + 35.1 amu = 64 amu
B. Bài tập trắc nghiệm KHTN 7 Bài 2: Nguyên tử
Câu 1. Cho sơ đồ nguyên tử nitrogen như sau:
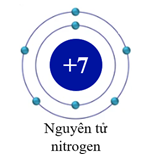
Số electron và số lớp electron trong nguyên tử nitrogen là
A. 7 và 2.
B. 7 và 3.
C. 8 và 2.
D. 8 và 3.
Đáp án: A
Giải thích:
Lớp thứ nhất (gần hạt nhân nhất) có 2 electron.
Lớp thứ hai có 5 electron.
Nguyên tử nitrogen có 7 electron và sắp xếp vào 2 lớp.
Câu 2. Khối lượng nguyên tử được tính như thế nào?
A. mnguyên tử melectron + mproton.
B. mnguyên tử melectron + mneutron.
C. mnguyên tử mneutron + mproton.
D. mnguyên tử mproton.
Đáp án: C
Giải thích: Khối lượng của một nguyên tử bằng tổng khối lượng của proton, neutron trong hạt nhân và các hạt electron ở vỏ nguyên tử.
Một proton có khối lượng gần đúng bằng khối lượng của một neutron và xấp xỉ bằng 1 amu. Một electron có khối lượng xấp xỉ bằng 0,00055 amu, nhỏ hơn nhiều lần so với khối lượng của proton và neutron nên có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân. Hay khối lượng nguyên tử xấp xỉ bằng tổng khối lượng của proton và neutron.
Câu 3. Nguyên tử aluminium có 13 proton và 14 neutron. Khối lượng gần đúng của nguyên tử aluminium là
A. 13 amu.
B. 14 amu.
C. 27 amu.
D. 40 amu.
Đáp án: C
Giải thích: Một proton có khối lượng gần đúng bằng khối lượng của một neutron và xấp xỉ bằng 1 amu.
Khối lượng gần đúng của nguyên tử aluminium là: 13×1 + 14×1 = 27 (amu).
Câu 4. Cho biết sơ đồ của nguyên tử chlorine như sau:
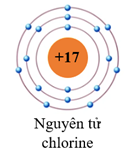
Số proton và số electron ở lớp ngoài cùng lần lượt là
A. 17 proton và 7 electron ngoài cùng.
B. 17 proton và 8 electron ngoài cùng.
C. 10 proton và 7 electron ngoài cùng.
D. 17 proton và 17 electron ngoài cùng.
Đáp án: A
Giải thích:
Vỏ nguyên tử chlorine có 17 electron. Trong đó, lớp 1 có 2 electron, lớp 2 có 8 electron và lớp 3 (lớp ngoài cùng) có 7 electron.
Số proton trong hạt nhân bằng số electron ở vỏ nguyên tử và bằng 17 hạt.
Câu 5. Cho sơ đồ nguyên tử carbon và oxygen như sau:
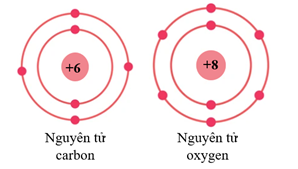
Khẳng định nào sau đây là sai?
A. Nguyên tử carbon có ít electron hơn nguyên tử oxygen.
B. Nguyên tử carbon và nguyên tử oxygen đều cần thêm 4 electron để lớp ngoài cùng có số electron tối đa.
C. Nguyên tử carbon và nguyên tử oxygen đều có 2 lớp electron.
D. Số electron ở lớp ngoài cùng của nguyên tử carbon và oxygen lần lượt là 4e và 6e.
Đáp án: B
Giải thích:
Nguyên tử carbon có 6 electron, nguyên tử oxygen có 8 electron A đúng
Nguyên tử carbon có 2 lớp electron. Trong đó, lớp 1 có 2 electron và lớp 2 có 4 electron.
Nguyên tử oxygen có 2 lớp electron. Trong đó, lớp 1 có 2 electron và lớp 2 có 6 electron.
C và D đúng
Lớp thứ hai có tối đa 8 electron. Vậy nguyên tử carbon và nguyên tử oxygen cần thêm lần lượt là 4e và 2e để lớp ngoài cùng có số electron tối đa. B sai
Câu 6. Nguyên tử là
A. hạt vô cùng nhỏ, trung hòa về điện.
B. hạt vô cùng nhỏ, mang điện tích âm.
C. hạt vô cùng nhỏ, mang điện tích dương.
D. hạt có kích thước gần như hạt cát, không mang điện.
Đáp án: A
Giải thích: Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện.
Câu 7. Các hạt cấu tạo nên hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Đáp án: D
Giải thích:
Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm.
Hạt nhân nguyên tử gồm các hạt proton mang điện tích dương và neutron không mang điện.
Vỏ nguyên tử gồm các hạt electron mang điện tích âm sắp xếp thành từng lớp.
Các hạt cấu tạo nên hầu hết các nguyên tử là proton, electron và neutron.
Câu 8. Trong nguyên tử, hạt nào không mang điện?
A. negatron.
B. neutron.
C. electron.
D. proton.
Đáp án: B
Giải thích: Nguyên tử gồm 3 loại hạt cấu tạo nên là electron, proton và neutron. Trong đó neutron là hạt không mang điện, có điện tích bằng 0.
Câu 9. Phần khu vực trung tâm trong nguyên tử, nơi chứa các hạt proton và neutron được gọi là
A. lõi.
B. đám mây electron.
C. hạt nhân.
D. trung tâm.
Đáp án: C
Giải thích: Nguyên tử có cấu tạo rỗng gồm hạt nhân mang điện tích dương ở trung tâm gồm các hạt proton và neutron.
Câu 10. Hạt mang điện tích dương trong nguyên tử là
A. positron.
B. neutron.
C. electron.
D. proton.
Đáp án: D
Giải thích:
Nguyên tử được tạo nên từ các hạt proton, neutron và electron. Trong đó:
+ Electron (e) mang một đơn vị điện tích âm, quy ước là –1.
+ Proton (p) mang một đơn vị điện tích dương, quy ước là +1.
+ Neutron (n) không mang điện.
Xem thêm các bài tóm tắt lý thuyết Khoa học tự nhiên 7 Kết nối tri thức hay, chi tiết khác:
Bài 1: Phương pháp và kĩ năng học tập môn khoa học tự nhiên
Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 5: Phân tử - Đơn chất - Hợp chất