Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng lớp 12.
Bài giảng Hóa học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Giải bài tập Hóa học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Câu hỏi và bài tập (trang 132 SGK Hóa Học 12)
Bài 1 trang 132 SGK Hóa Học 12: Cho 3,04 gam hỗn hợp NaOH và KOH tác dụng với dung dịch axit HCl thu được 4,15 gam hỗn hợp muối clorua. khối lượng của mỗi muối hiđrôxit trong hỗn hợp lần lượt là
A. 1,17 gam và 2,98 gam.
B. 1,12 gam và 1,6 gam.
C. 1,12 gam và 1,92 gam.
D. 0,8 gam và 2,24 gam.
Phương pháp giải:
Gọi số mol của NaOH và KOH lần lượt là x và y (mol)
PTHH:
NaOH + HCl → NaCl + H2O
x x (mol)
KOH + HCl → KCl + H2O
y y (mol)
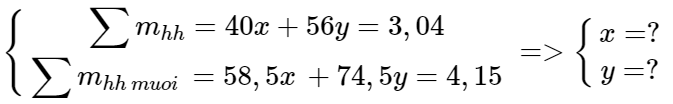
Lời giải:
Gọi số mol của NaOH và KOH lần lượt là x và y (mol)
PTHH:
NaOH + HCl → NaCl + H2O
x x (mol)
KOH + HCl → KCl + H2O
y y (mol)
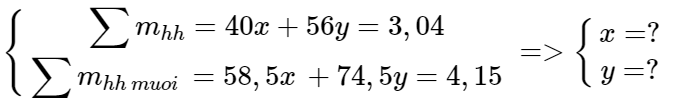
=> mNaOH = 40. 0,02= 0,8 (g)
mKOH = 56.0,04= 2,24 (g)
Đáp án D
Bài 2 trang 132 SGK Hóa Học 12: Sục 6,72 lít khí CO2 (đktc) vào dung dịch có chứa 0,25 mol Ca(OH)2. Khối lượng kết tủa thu được là
A.10 gam. B. 15 gam.
C. 20 gam. D. 25 gam.
Phương pháp giải:
Lập tỉ lệ
Nếu k ≤ 1 => chỉ tạo muối CaCO3. Mọi tính toán theo số mol của CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
=> nCaCO3 = nCO2 => mCaCO3 = ?
Nếu k ≥ 2 => chỉ tạo muối Ca(HCO3)2. Mọi tính toán theo số mol của Ca(OH)2
2CO2 + Ca(OH)2 → Ca(HCO3)2
=> mCaCO3 = 0
Nếu 1 < k < 2 => Tạo cả 2 muối CaCO3 và Ca(HCO3)2. Tính toán theo số mol CO2 và Ca(OH)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
x x (mol)
2CO2 + Ca(OH)2 → Ca(HCO3)2
2y y (mol)
Giải hệ 2 ẩn 2 phương trình
=> mCaCO3 = 100x = ?
Lời giải:
Cách 1:
nCO2 = 6,72: 22,4 = 0,3 (mol)
Ta có:
=> 1< k < 2 => Tạo 2 muối
CO2 + Ca(OH)2 → CaCO3↓ + H2O
x x x (mol)
2CO2 + Ca(OH)2 → Ca(HCO3)2
y y y (mol)
=> mCaCO3 = 0,2.100 = 20 (gam).
Cách 2:
Số mol CO2 là
CO2 + Ca(OH)2 CaCO3 + H2O (1)
0,25 0,25 0,25 (mol)
Theo phương trình (1):
Xảy ra phản ứng:
CO2 + CaCO3 + H2O Ca(HCO3)2 (2)
0,05 0,05 (mol)
Theo phương trình (2):
Như vậy CaCO3 không bị hòa tan là 0,25 – 0,05 = 0,2 mol
Khối lượng kết tủa thu được là m = 0,2.100 = 20 gam
Đáp án C
Bài 3 trang 132 SGK Hóa Học 12: Chất nào sau đây có thể dùng để làm mềm nước cứng có tính cứng vĩnh cửu?
A. NaCl; B. H2SO4;
C. Na2CO3; D. HCl.
Phương pháp giải:
hi nhớ: Nước cứng vĩnh cửu là nước chứa các ion: Ca2+; Mg2+; SO42-; Cl-
=> Chọn chất làm kết tủa được ion Ca2+; Mg2+ sẽ làm mềm được nước.
Lời giải:
Dùng Na2CO3 để làm mềm nước cứng vĩnh cửu
Đáp án C
Bài 4 trang 132 SGK Hóa Học 12: Có 28,1 gam hỗn hợp MgCO3 và BaCO3 trong đó MgCO3 chiếm a% khối lượng. Cho hỗn hợp trên tác dụng hết dụng với dung dịch axit HCl để lấy khí CO2 rồi đem sục vào dung dịch có chứa 0,2 mol Ca(OH)2 được kết tủa B. Tính a để kết B thu được là lớn nhất.
Phương pháp giải:
Kết tủa thu được lớn nhất khi nCaCO3 = nCa(OH)2 = nCO2
Tức tất cả lượng CO2 sinh ra từ phản ứng phân hủy CaCO3 và MgCO3 chuyển hết thành CaCO3↓
Gọi số mol của MgCO3 và BaCO3 lần lượt là x và y (mol)
Lời giải:MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Gọi số mol của MgCO3 và BaCO3 lần lượt là x và y (mol)
Cách 1:
Cách 2:
(1)
(2)
Từ (1) và (2)
Bài 5 trang 132 SGK Hóa Học 12: Cách nào sau đây thường được dùng để điều chế kim loại Ca?
A. Điện phân dung dịch CaCl2 có màng ngăn.
B. Điện phân CaCl2 nóng chảy;
C. Dùng Al để khử CaO ở nhiệt độ cao;
D. Dùng kim loại Ba để đẩy Ca ra khỏi dung dịch CaCl2
Phương pháp giải:
Lời giải:
Đáp án B
Bài 6 trang 132 SGK Hóa Học 12: Sục a mol khí CO2 vào dung dịch Ca(OH)2 thu được 3 gam kết tủa. Lọc tách kết tủa, dung dịch còn lại mang đun nóng thu thêm được 2 gam kết tủa nữa. Giá trị của a là
A. 0,05 mol. B. 0,06 mol.
C. 0,07 mol. D. 0,08 mol.
Phương pháp giải:
Viết phương trình hóa học xảy ra, tính toán theo phương trình hóa học
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
2CO2 + Ca(OH)2 →Ca(HCO3)2 (2)
Ca(HCO3)2 CaCO3 + CO2 + H2O (3)
Lời giải:
nCaCO3 (1) = 0,03 mol; nCaCO3 (3) = 0,02 mol.
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
0,03 0,03 (mol)
2CO2 + Ca(OH)2→ Ca(HCO3)2 (2)
0,04 0,02 (mol)
Ca(HCO3)2 CaCO3 ↓ + CO2 + H2O (3)
0,02 0,02 (mol)
Từ (1), (2) và (3) => nCO2 = a = 0,03 + 0,04 = 0,07 (mol).
Đáp án C
Lý thuyết Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng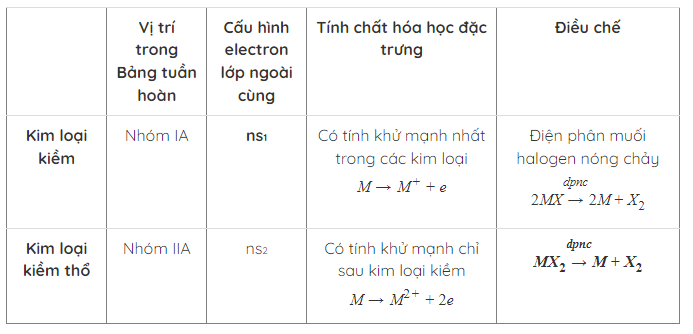
2. Một số hợp chất quan trọng của kim loại kiềm.
- NaOH: là bazơ mạnh, tan nhiều trong nước và tỏa nhiệt.
- NaHCO3: tác dụng được với axit và kiềm.
- Na2CO3: là muối của axit yếu, có đầy đủ tính chất chung của muối.
- KNO3: 2KNO3  2KNO2 + O2
2KNO2 + O2
3. Một số hợp chất quan trọng của kim loại kiềm thổ
- Ca(OH)2: là bazơ mạnh.
- CaCO3: CaCO3  CaO + CO2
CaO + CO2
- Ca(HCO3)3: Ca(HCO3)3  CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O
- CaSO4: tùy theo lượng nước kết tinh có trong tinh thể ta có; thạch cao sống (CaSO4.2H2O); thạch cao nung (CaSO4. H2O); thạch cao khan (CaSO4).
4. Nước cứng
- Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+, nước mềm là nước chứa ít hoặc không chứa các ion trên.
- Phân loại:
+ Nước cứng có tính cứng tạm thời: chứa Ca(HCO3)2 và Mg(HCO3)2.
+ Nước cứng có tính cứng vĩnh cửu: chứa các muối clorua và sunfat của canxi và magie.
+ Nước cứng có tính cứng toàn phần: có cả tính cứng tạm thời và tính cứng vĩnh cửu.
- Cách làm mềm nước cứng: phương pháp kết tủa và phương pháp trao đổi ion.