Tailieumoi.vn giới thiệu Giải sách bài tập Hoá học lớp 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 12. Mời các bạn đón xem:
Bài giảng Hóa học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Giải SBT Hoá học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Bài 28.1 trang 65 SBT Hoá học 12: Có 3 lọ, mỗi lọ đựng một dung dịch sau: BaCl2, Ba(NO3)2, Ba(HCO3)2. Chỉ dùng thuốc thử nào sau đây có thể nhận biết được các dung dịch trên
A. Quỳ tím. B. Phenolphtalein.
C. Na2CO3 D. AgNO3.
Phương pháp giải:
Đun nóng các dung dịch, nhận biết được Ba(HCO3)2
Dùng thuốc thử AgNO3 nhận biết hai chất còn lại
Lời giải:
- Đun nóng các dung dịch, có kết tủa xuất hiện là dung dịch Ba(HCO3)2
- Cho AgNO3 vào 2 dung dịch còn lại, có kết tủa là dung dịch BaCl2 :
Chọn D.
Bài 28.2 trang 65 SBT Hoá học 12: Điện phân nóng chảy 4,25 g muối clorua của một kim loại kiềm thu được 1,568 lít khí tại anot (đo ở 109,2°c và 1 atm). Kim loại kiềm đó là
A. Li. B. Na.
C. K. D. Rb.
Phương pháp giải:
Gọi công thức của muối clorua là MCl
Viết phương trình phản ứng
Tính số mol Cl2 theo công thức
Dựa vào phương trình, tính được số mol MCl
Suy ra phân tử khối của MCl và nguyên tử khối của M, từ đó tìm được kim loại M
Lời giải:
Gọi công thức của muối clorua là MCl
Theo phương trình:
Vậy M là Li.
Chọn A.
Bài 28.3 trang 65 SBT Hoá học 12: Cho 21,6 g một kim loại chưa biết hoá trị tác dụng hết với dung dịch HNO3 loãng thu được 6,72 lít N2O duy nhất (đktc). Kim loại đó là
A. Na. B. Zn.
C. Mg. D. Al.
Phương pháp giải:
Gọi kim loại cần tìm là R có hóa trị n không đổi
Áp dụng phương pháp bảo toàn electron, tìm ra số mol của kim loại
Áp dụng công thức tính được nguyên tử khối của kim loại, suy ra kim loại R.
Lời giải:
Gọi kim loại cần tìm là R có hóa trị n không đổi
Áp dụng bảo toàn electron:
Với n = 3 thì MR = 27 (Al)
Vậy kim loại R là Nhôm (Al)
Chọn D.
Bài 28.4 trang 66 SBT Hoá học 12: Sục 11,2 lít khí SO2 (đktc) vào dung dịch NaOH dư, dung dịch thu được cho tác dụng với BaCl2 dư thì khối lượng kết tủa thu được là
A. 107,5 g. B. 108,5g
C. 106,5 g. D. 105,5g.
Phương pháp giải:
Viết phương trình phản ứng
Tính số mol kết tủa BaSO3 theo phương trình phản ứng, từ đó suy ra khối lượng của kết tủa
Lời giải:
PTHH:
Theo phương trình (1),
Theo phương trình (2),
Chọn B.
Bài 28.5 trang 66 SBT Hoá học 12: Sục V lít khí SO2 (đktc) vào dung dịch brom dư thu được dung dịch X. Cho BaCl2 dư vào dung dịch X thu được 23,3 g kết tủa. V có giá trị là
A. 1,12 B. 2,24.
C. 3,36. D. 6,72.
Phương pháp giải:
Viết phương trình phản ứng
Từ số mol của kết tủa suy ra số mol của SO2, từ đó tìm được V
Lời giải:
PTHH: (1)
(2)
Theo phương trình (2),
Theo phương trình (1),
Chọn B.
Bài 28.6 trang 66 SBT Hoá học 12: Cho 5,75 g hỗn hợp Mg, Al và Cu tác dụng với dung dịch HNO3 loãng, dư thu được 1,12 lít (đktc) hỗn hợp khí X gồm NO và N2O (đktc). Tỉ khối của X đối với khí H2 là 20,6. Khối lượng muối nitrat sinh ra trong dung dịch là
A. 27,45 g. B. 13,13 g.
C. 58,91 g D. 17,45 g.
Phương pháp giải:
Gọi số mol của NO và N2O lần lượt là x và y
Lập phương trình tổng số mol 2 khí
Từ tỷ khối của X so với H2, tìm MX, suy ra khối lượng của X
Lập phương trình tổng khối lượng 2 khí
Từ 2 phương trình,giải hệ phương trình, tìm ra số mol mỗi khí
Áp dụng công thức:
Áp dụng bảo toàn khối lượng:
Lời giải:
Gọi số mol của NO và N2O lần lượt là x và y
(1)
Ta có:
(2)
Từ (1) và (2)
Lại có
Chọn A.
Bài 28.7 trang 65 SBT Hoá học 12: Xác định các chất trong chuỗi phản ứng :
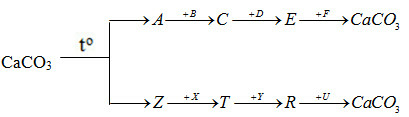
Phương pháp giải:
Dựa vào tính chất của các hợp chất để lựa chọn chất phù hợp
Lời giải:
A: CaO B: H2O
C: Ca(OH)2 D: HCl
E: CaCl2 F: Na2CO3
Z: CO2 X: Ba(OH)2
T: Ba(HCO3)2 Y: KOH
R: K2CO3 U: Ca(NO3)2
Bài 28.8 trang 65 SBT Hoá học 12: Xác định các chất trong chuỗi phản ứng sau :
A + B → C + H2O
D+ A → B hoặc C
Biết D là hợp chất của cacbon. A, B, C là hợp chất của một kim loại, khi đốt nóng cho ngọn lửa màu vàng.
Phương pháp giải:
Dựa vào các phản ứng đặc trưng của các kim loại kiềm, kiềm thổ và hợp chất
Lời giải:
A: NaOH B: NaHCO3 C: Na2CO3 D: CO2
Bài 28.9 trang 66 SBT Hoá học 12: Cho các chất : MgCO3, MgO, Mg(OH)2, MgCl2, MgSO4. Hãy viết PTHH của các chuỗi phản ứng có thể xảy ra theo sơ đồ:
A ⟶ B ⟶ C ⟶ D ⟶ E
Phương pháp giải:
Dựa vào mối quan hệ của các hợp chất của Magie để xây dựng sơ đồ phản ứng.
Lời giải:
Có nhiều chuỗi phản ứng phù hợp sơ đồ trên. Ví dụ :
MgO ⟶ MgCl2 ⟶ MgCO3 ⟶ MgSO4 ⟶ Mg(OH)2
MgO ⟶ MgSO4 ⟶ MgCO3 ⟶ MgCl2 ⟶ Mg(OH)2
MgCO3 ⟶ MgO ⟶ MgCl2 ⟶ MgSO4 ⟶ Mg(OH)2
Mg(OH)2 ⟶ MgCl2 ⟶ MgCO3 ⟶ MgO ⟶ MgSO4
Bài 28.10 trang 66 SBT Hoá học 12: Ion Ca2+ có cấu hình electron giống với cấu hình electron của nguyên tử khí hiếm và ion halogen nào ? Viết cấu hình electron của chúng.
Phương pháp giải:
Viết cấu hình electron của ion Ca2+ và so sánh với các nguyên tử và ion khác.
Lời giải:
Cấu hình của ion Ca2+ : 1s22s22p63s23p6.
Giống cấu hình electron của nguyên tử khí hiếm đứng trước nó là agon (Ar) và cấu hình electron của ion Cl-
Bài 28.11 trang 65 SBT Hoá học 12: Bằng những phản ứng hoá học nào có thể phân biệt được các chất trong mỗi dãy sau ?
a) Các kim loại : Al, Mg, Ba, Na.
b) Các dung dịch muối : NaCl, Ba(NO3)2, Al(SO4)3.
c) Các oxit : CaO, FeO, Al2O3.
d) Các dung dịch : NaNO3, Ca(NO3)2, Al(NO3)3.
Phương pháp giải:
a. Dùng H2O để xếp các kim loại vào 2 nhóm: tan và không tan
Nhóm kim loại tan phân biệt bằng ion , nhóm kim loại không tan phân biệt bằng dung dịch NaOH
b. Dùng NaOH và muối cacbonat để nhận biết các chất
c. Dùng H2O và dung dịch NaOH để nhận biết các chất
d. Dùng dung dịch NaOH
a) Dùng H2O, nhận biết được 2 nhóm kim loại Na, Ba và Mg, Al. Nhận biết ion Ba2+ trong nhóm ( 1 ) bằng ion CO3 2- . Nhận biết kim loại Al trong nhóm (2) bằng dung dịch NaOH.
b) Nhận biết ion Al3+ bằng dung dịch NaOH, sau đó nhận biết ion Ba2+ bằng dung dịch muối cacbonat, còn lại là dung dịch chứa Na+.
c) Dùng H2O nhận biết CaO, dùng dung dịch NaOH nhận biết Al2O3, chất còn lại là FeO.
d) Dùng dung dịch NaOH nhận biết: Al(NO3)3 tạo kết tủa sau đó tan trong dung dịch NaOH dư ; Ca(NO3)2 làm dung dịch vẩn đục, còn lại là NaNO3.
Bài 28.12 trang 65 SBT Hoá học 12: Trình bày phương pháp điều chế từng kim loại riêng biệt từ hỗn hợp những chất NaCl, Al2O3, MgCO3. Viết các phương trình hoá học.
Phương pháp giải:
Dựa vào lý thuyết phần điều chế các kim loại kiềm, kiềm thổ, nhôm để chọn phương pháp phù hợp.
Lời giải:
Dùng nước tách được NaCl. Cô cạn dung dịch được NaCl rắn. Điện phân NaCl nóng chảy, được kim loại Na.
Dùng dung dịch NaOH dư, tách được chất rắn MgCO3 và dung dịch NaAlO2. Từ MgCO3 điều chế kim loại Mg theo sơ đồ chuyển hoá sau:
Từ natri aluminat điều chế Al theo sơ đồ chuyển hóa:
Bài 28.13 trang 65 SBT Hoá học 12: Một hỗn hợp rắn gồm Ca và CaC2 tác dụng với nước (dư) thu được hỗn hợp khí có tỉ khối đối với H2 là 5. Đế trung hoà dung dịch sau phản ứng, cần dùng 600 ml dung dịch HCl 0,5M. Tính :
a) Khối lượng của hỗn hợp rắn đã dùng ban đầu.
b) Thành phần phần trăm thể tích của hỗn hợp khí
Phương pháp giải:
a. Đặt x và y là số mol của Ca và CaC2
Viết phương trình hóa học
Lập phương trình tổng số HCl phản ứng
Lập phương trình tỷ khối của hỗn hợp khí
Giải hệ phương trình, suy ra số mol mỗi chất, từ đó tính được khối lượng hỗn hợp rắn ban đầu.
b. Tính số mol mỗi khí dựa vào số mol Ca và CaC2
Từ đó tính % thể tích mỗi khí
Lời giải:
a) Ca + H2O → Ca(OH)2 + H2 (1)
CaC2 + 2H2O → Ca(OH)2 + C2H2 (2)
Ca(OH)2 + 2HCl→ CaCl2 + 2H2O (3)
Đặt x, y lần lượt là số mol Ca và CaC2 . Hỗn hợp khí thu được gồm H2 (x mol) và C2H2 (y mol)
Ta có hệ pt:
→ x= 0,1 mol ; y= 0,05 mol
Khối lượng hỗn hợp rắn ban đầu:
m Ca= 40.0,1=4 g mCaC2= 64.0,05= 3,2 g
→m hh= 7,2g
b)
Bài 28.14 trang 66 SBT Hoá học 12: Một bình kín có dung tích 5 lít chứa khí ở áp suất 1,4 atm và 27°C. Đốt cháy 12 g kim loại kiềm thổ trong bình kín trên. Sau phản ứng, nhiệt độ và áp suất trong bình là 136,5°C và 0,903 atm. Biết thể tích bình không đổi, thể tích chất rắn không đáng kể. Xác định kim loại kiềm thổ đem đốt.
Phương pháp giải:
Tính thể tích khí O2 trước và sau phản ứng, suy ra thể tích khí O2 đã phản ứng, đổi thành số mol
Tính số mol kim loại theo số mol khí O2 phản ứng.
Suy ra nguyên tử khối của kim loại, từ đó tìm được kim loại
Lời giải:
2M + O2 → 2MO
Thể tích O2 (đktc) có trong bình trước phản ứng:
Thể tích khí O2 còn lại trong bình sau phản ứng:
Thể tích khí O2 tham gia phản ứng: 6,37- 3,01= 3,36 l hay 0,15 mol O2.
→ số mol kim loại tham gia phản ứng là 0,3 mol
Khối lượng mol của M là M là canxi.
Bài 28.15 trang 66 SBT Hoá học 12: Hoà tan 1,04 g muối clorua của kim loại kiềm thổ trong nước thu được dung dịch A. Thêm Na2CO3 dư vào dung dịch A được một kết tủa. Hoà tan kết tủa này trong dung dịch HNO3 được dung dịch B. Thêm H2SO4 dư vào dung dịch B được kết tủa mới có khối lượng 1,165 g. Xác định công thức hoá học của muối clorua kim loại kiềm .
Phương pháp giải:
Đặt X là khối lượng mol của kim loại kiềm thổ cần tìm
Viết sơ đồ phản ứng
Áp dụng tăng giảm khối lượng để tìm X
Kết luận kim loại cần tìm
Lời giải:
Đặt X là khối lượng mol của kim loại kiểm thổ.
Theo sơ đồ phản ứng : 1 mol MCl2 →1 mol MSO4
(X + 71) g MCl2 → (X + 96) g MSO4
1,04 g MCl2 → 1,165 g MSO4
⟹ 1,165.(X + 71) = 1,04.(X + 96)
Giải ra được X = 137. Vậy M là Ba, muối là BaCl2.
Bài 28.16 trang 65 SBT Hoá học 12: Cho 10,6 g hỗn hợp A gồm một kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với 300 ml dung dịch HCl 1M (loãng), thu được dung dịch B và 5,6 lít khí (đktc).Dẫn từ từ khí CO2 vào dung dịch B. Số gam kết tủa cực đại thu được là bao nhiêu.
Phương pháp giải:
Đặt hai kim loại là , có hoá trị n (1 < n< 2)
Từ số mol H2, tìm được số mol hỗn hợp kim loại, từ đó giới hạn khoảng cho MR
Mà hai kim loại có phản ứng với nước
Kết luận hai kim loại
Lập phương trình tổng khối lượng 2 kim loại
Lập phương trình tổng số mol khí
Giải hệ phương trình, tìm dc số mol mỗi kim loại
Suy ra số mol nhóm OH-
Kết tủa cực đại khi tạo muối cacbonat, suy ra khối lượng kết tủa
Lời giải:
Đặt hai kim loại là , có hoá trị n (1 < n< 2), ta có phương trình cho nhận e :
Với số mol H2 là 0,25 (mol) ⟹ số mol R là (mol)
Với
Vậy 2 kim loại cần tìm có thể là 2 trong 4 kim loại sau : Na, K, Mg, Ca.
Mặt khác ta có : nHCl = 0,3 mol ⟹ nH2 = 0,15mol, vậy 0,1 mol H2 còn lại do H2O phản ứng tạo ra ⟹ loại Mg vì Mg không phản ứng với nước
⟹ hai kim loại là Na và Ca với số mol tương ứng là x và y
Ta có hệ:
23x + 40y = 10,6 (1)
x + 2y = 0,25.2 = 0,5 (2)
từ (1) và (2) ⟶ x = 0,2 ; y = 0,15
Ta lại có số mol H2 do nước tạo ra là 0,1 mol ⟹ số mol OH- là 0,2 mol
Để tạo kết tủa cực đại tức là toàn bộ CO2 tạo muối CO3 2-
Vậy kết tủa là CaCO3 : 0,1 mol ⟹ m = 0,1.100 = 10 (gam).
Bài 28.17 trang 65 SBT Hoá học 12: Hoà tan 0,1 mol phèn nhôm - amoni (NH4)2SO4.Al2(SO4)3.24H2O vào nước được dung dịch X. Cho đến dư dung dịch Ba(OH)2 vào dung dịch X (đun nóng) thì thu được kết tủa Y và khí Z. Xác định khối lượng kết tủa Y và thể tích (đktc) khí Z.
Phương pháp giải:
Vì Ba(OH)2 dư nên không có kết tủa Al(OH)3
Từ số mol phèn nhôm – amoni tính số mol ion và
Viết phương trình tạo kết tủa, tính số mol kết tủa theo số mol ion
Viết phương trình tại khí, tính số mol khí theo số mol
Lời giải:
- Dung dịch Ba(OH)2 dư nên Al(OH)3 sinh ra rồi tan hết.
- Phèn amoni (NH4)2SO4.Al2(SO4)3.24H2O: 0,1 mol
⟹ nSO42- = 0,4 mol và nNH4+ = 0,2 mol
Kết tủa Y : Ba2+ + SO42-→ BaS04 ↓
→m↓ = mBaSO4= 0,4.233 = 93,2 (g)
Khí Z : NH4 + + OH- → NH3↑+H2O
⟹ VNH3 = 0,2.22,4 = 4,48 (lít).