Tailieumoi.vn giới thiệu Giải bài tập Hóa học 8 Bài 43: Pha chế dung dịch, chi tiết nhất giúp học sinh dễ dàng làm bài tập Pha chế dung dịch lớp 8.
Đặt khối lượng dung dịch ban đầu là m gam
Vậy khối lượng dung dịch sau khi làm bay hơi là: (m - 60) gam
Khối lượng chất tan có trong dung dịch trước và sau khi làm bay hơi là không đổi, ta có:
mct = =
⇔ 15 . m = 18(m - 60)
⇔ 15m = 18m - 1080
⇔ 3m = 1080
⇔ m = 360 gam
Vậy khối lượng dung dịch ban đầu là 360 gam
Nồng độ phần trăm của dung dịch:
C% = . 100% = . 100% = 18%
Khối lượng dung dịch Na2CO3:
m = 200 . 1,05 = 210 g
Nồng độ phần trăm của dung dịch:
C% = . 100% = 5,05%
Số mol của Na2CO3 là:
n = = 0,1 mol
Đổi 200 ml = 0,2 lít
Nồng độ mol của dung dịch:
CM = = 0,5 M
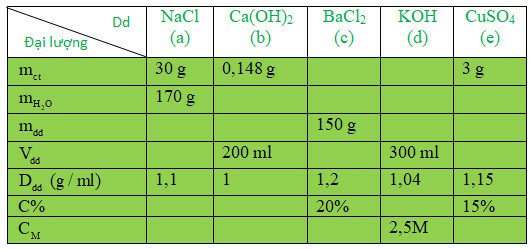
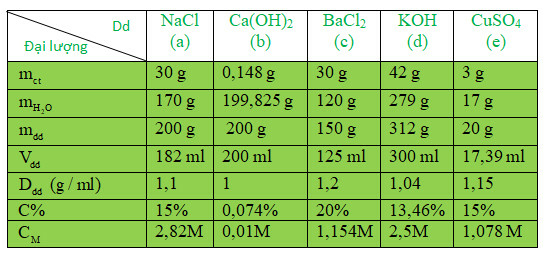
Lời giải:
Dung dịch NaCl
+ mdd = 30 + 170 = 200 gam
+ lít
+
+
+
Dung dịch Ca(OH)2
+ mdd = V.D = 200 gam
+ gam
+
+
+ Đổi V = 200 ml = 0,2 lít
Dung dịch BaCl2
+ mdd = mct . C% = 30 gam
+
+ lít
+
+
Dung dịch KOH
+ nKOH = CM . V = 2,5.0,3 = 0,75 mol
+ mct = 56.0,75 = 42 gam
+ mdd = V.D = 300.1,04 = 312 gam
+
+
Dung dịch CuSO4
+
+
+ lít
+
+
- Nhiệt độ của dung dịch muỗi bão hòa là 200C
- Chén sứ nung có khối lượng 60,26 g
- Chén sứ đựng dung dịch muối có khối lượng 86,26 g
- Khối lượng chén nung và muối kết tinh sau khi làm bay hết hơi nước là 66,26 g
Hãy xác định độ tan của muối ở nhiệt độ 200C
Lời giải:
Ta có: mdd = 86,26 – 60,26 = 26 (gam)
mct = 66,26 – 60,26 = 6 (gam)
Ở 20℃, cứ 20 gam nước hòa tan 6 gam muối tạo dung dịch bão hòa.
Vậy ở 20℃, 100 gam nước hòa tan khối lượng muối là:
Vậy độ tan của muối ở 20℃ là 30 gam
1. Pha chế dung dịch theo nồng độ cho trước
Bước 1: Tính các đại lượng cần dùng
Bước 2: Pha chế dung dịch theo các đại lượng cần xác định
* Pha dung dịch nồng độ mol/l (CM):
Từ muối A, nước cất và các dụng cụ cần thiết, hãy pha chế V (ml) dung dịch A nồng độ CM
Bước 1: Tính số mol chất tan có trong dung dịch cần pha chế:
Vì đơn vị của nồng độ mol là mol/lít nên thể tích dung dịch phải đổi về lít, sau đó tính số mol theo công thức:
n = CM . V
Bước 2: Từ số mol suy ra khối lượng chất tan (m) cần lấy để pha chế.
Bước 3: Thể tích dung dịch chính là thể tích nước cần dùng để pha chế.
Kết luận: vậy cần lấy m gam A hòa tan vào V (ml) nước cất để tạo thành V (ml) dung dịch A có nồng độ CM
* Pha dung dịch nồng độ phần trăm:
Từ muối B, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế m gam dung dịch B có nồng độ C%.
Bước 1: Tính khối lượng chất tan cần pha chế:
Bước 2: Tính khối lượng nước cần pha chế:
Cần nhớ công thức tính khối lượng dung dịch: mdung dịch = mdung môi + mchất tan
=> m2 = mnước = mdung dịch - mchất tan
Kết luận: Vậy cần lấy m1 gam chất B hòa tan vào m2 gam nước để thu được m gam dung dịch B có nồng độ C%.
2. Pha loãng hoặc cô đặc một dung dịch theo nồng độ cho trước
a) Đặc điểm:
- Khi pha loãng, nồng độ dung dịch giảm. Còn cô đặc, nồng độ dung dịch tăng.
- Dù pha loãng hay cô đặc, khối lượng chất tan luôn luôn không thay đổi.
b) Cách làm:
- Vì khối lượng chất tan không đổi dù pha loãng hay cô đặc nên:
+ Đối với bài tập nồng độ %: mdd(1) . C%(1) = mdd(2) . C%(2)
+ Đối với bài tập nồng độ mol: Vdd(1) . CM (1) = Vdd(2) . CM (2)
Tổng quát: Pha V2 (ml) dung dịch A có nồng độ CM2 (M) từ dung dịch A có nồng độ CM1 (M)
Bước 1: Tính toán
- Tìm số mol chất tan có trong V2 (ml) dung dịch A nồng độ CM2 (M):
n = CM2.V2
- Vì pha loãng dung dịch là thêm nước cất => số mol chất tan là không thay đổi.
- Tính thể tích dung dịch A nồng độ CM1 (M):
=> Thể tích nước cần thêm là: Vnước = V2 – V1
Bước 2: Pha chế dung dịch