Tailieumoi.vn giới thiệu Giải bài tập Hóa học 8 Bài 42: Nồng độ dung dịch, chi tiết nhất giúp học sinh dễ dàng làm bài tập Nồng độ dung dịchlớp 8.
A. Hòa tan 190 g BaCl2 trong 10 g nước.
B. Hòa tan 10 g BaCl2 trong 190 g nước.
C. Hòa tan 200 g BaCl2 trong 10 g nước.
D. Hòa tan 10 g BaCl2 trong 200 g nước.
Lời giải:
Ta có:
Khối lượng của chất tan BaCl2 có trong dung dịch là:
mdd = mnước + mchất tan
Khối lượng nước có trong dung dịch là: 200 - 10 = 190 (g)
Vậy hòa tan 10 gam BaCl2 vào 190 gam nước ta sẽ thu được 200 gam dung dịch BaCl2 5%
Đáp án B
A. 0,233 M; B. 23,3 M;
C. 2,33 M; D. 233M
Tìm đáp số đúng.
Lời giải:
Đổi 850 ml = 850 : 1000 = 0,85 lít
Nồng độ mol
Đáp án A
a) 1 mol KCl trong 750 ml dung dịch.
b) 0,5 mol MgCl2 trong 1,5 lít dung dịch
c) 400g CuSO4 trong 4 lít dung dịch
d) 0,06 mol Na2CO3 trong 1500 ml dung dịch
Lời giải:
Nồng độ mol của dung dịch:
a. Đổi 750 ml = 0,75 lít
=> V = 0,75 lít, n = 1 mol
=> CM = = 1,33 mol/l
b. V = 1,5 lít, n = 0,5 mol
=> CM = = 0,33 mol/l
c. Số mol CuSO4 : n = = = 2,5 mol
=> V = 4 lít, n = 2,5 mol
=> CM = = 0,625 mol/l
d. Đổi 1500 ml = 1,5 lít
=> V = 1,5 lít, n = 0,06 mol
=> CM = = 0,04 mol/l
Bài 4 trang 146 sgk hóa học 8: Hãy tính số mol và số gam chất tan trong mỗi dung dịch sau:
a. 1 lít dung dịch NaCl 0,5 M
b. 500 ml dung dịch KNO3 2 M.
c. 250 ml dung dịch CaCl2 0,1 M
d. 2 lít dung dịch Na2SO4 0,3 M
Lời giải:
a) V = 1 lít, CM = 0,5 M
Số mol NaCl: nNaCl = CM.V = 1.0,5 = 0,5 mol
Khối lượng NaCl: mNaCl = n.M = 0,5(23 + 35,5) = 29,25 g
b. Đổi 500 ml = 0,5 lít
=> V = 0,5 lít, CM = 2 M
Số mol KNO3: = CM.V = 2.0,5 = 1 mol
Khối lượng KNO3: = n.M = 1(39 + 14 + 48) = 101 g
c) Đổi 250 ml = 0,25 lít
=> V = 0,25 lít, CM = 0,1 M
Số mol CaCl2: = CM.V = 0,25.0,1 = 0,025 mol
Khối lượng CaCl2: = n.M = 0,025(40 + 71) = 2,775 g
d) V = 2 lít, CM = 0,3 M
Số mol Na2SO4: = CM.V = 2.0,3 = 0,6 mol
Khối lượng Na2SO4: = n.M = 0,6.(23.2 + 32 + 16.4) = 85,2 g
a) 20 g KCl trong 600 g dung dịch
b) 32 g NaNO3 trong 2 kg dung dịch
c) 75 g K2SO4 trong 1500 g dung dịch.
Lời giải:
Nồng độ phần trăm của dung dịch
a) C% = . 100% = . 100% = 3,33%
b) Đổi 2 kg = 2000 gam
C% = . 100% = . 100% = 1,6%
c) C% = . 100% = . 100% = 5%
a) 2,5 lít dung dịch NaCl 0,9 M
b) 50 g dung dịch MgCl2 4%
c) 250 ml dung dịch MgSO4 0,1 M
Lời giải:
Số gam chất tan cần dùng:
a. Có V = 2,5 lít, CM = 0,9M
Áp dụng công thức và m = n.M
b. m dung dịch = 50g, C% = 4%
Áp dụng công thức:
c. Có V = 250 ml = 0,25 lít, CM = 0,1M
Áp dụng công thức và m = n.M
Khối lượng dung dịch muối ăn:
mdd muối = 100 + 36 = 136 gam
Nồng độ phần trăm của dung dịch muối:
C% = . 100% = . 100% = 26,47%
Khối lượng dung dịch đường:
mdd đường = 100 + 204 = 304 gam
Nồng độ phần trăm của dung dịch đường:
C% = . 100% = . 100% = 67,1%
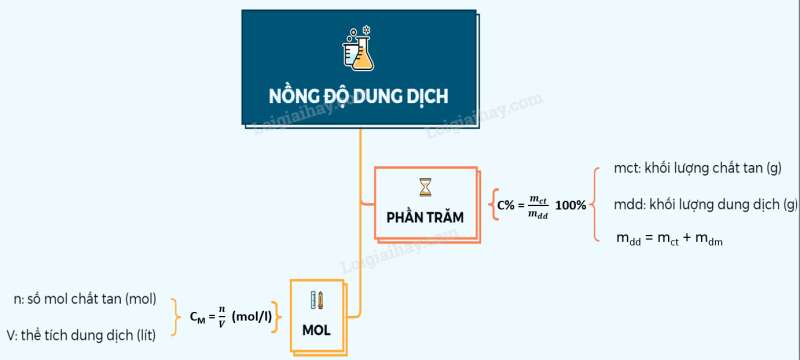
Lý thuyết nồng độ dung dịch
I. Nồng độ phần trăm: (C%)
* Nồng độ phần trăm (kí hiệu C%) của dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
Công thức:
Trong đó : C% : nồng độ phần trăm của dung dịch (%)
mct : khối lượng chất tan (gam)
mdd : khối lượng dung dịch (gam) = mdung môi + mchất tan
Từ công thức tính nồng độ phần trăm, ta suy ra các công thức sau:
- Công thức tính khối lượng dung dịch:
- Công thức tính khối lượng chất tan:
Ví dụ 1: Hoà tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Giải:
Khối lượng chất tan là: mct = 10 gam
Khối lượng dung dịch thu được là: mdd = mdm + mct = 40 + 10 = 50 gam
Áp dụng công thức:
II. Nồng độ mol của dung dịch (CM)
* Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan có trong một lít dung dịch.
Công thức tính:
Trong đó: CM là nồng độ mol (mol/lit)
n là số mol chất tan (mol)
Vdd là thể tích dung dịch (lit)
- Các công thức được suy ra từ công thức tính nồng độ mol của dung dịch:
+ Công thức tính số mol chất tan: n = CM . V
+ Công thức tính thể tích dung dịch:
Ví dụ: Tính khối lượng H2SO4 có trong 50 ml dung dịch H2SO4 2M
Giải:
Số mol H2SO4 có trong dung dịch H2SO4 2M là: = CM . V = 2 . 0,05 = 0,1 mol
=> Khối lượng H2SO4 là: = n . M = 0,1.98 = 9,8 gam
* Công thức chuyển đổi giữa nồng độ phần trăm và nồng độ mol:
Công thức tính nồng độ phần trăm: (1)
Khối lượng dung dịch được tính theo công thức: mdd = Ddd . V
với Ddd là khối lượng riêng của dung dịch (gam/lít) ; V là thể tích của dung dịch (lít)
Khối lượng chất tan là: mct = n . M
Thay vào (1) ta có:
Mà =>
=> Công thức chuyển từ nồng độ phần trăm sang nồng độ mol:
Lưu ý: Công thức tính này lấy đơn vị của Ddd là gam/lít, thường các đầu bài cho đơn vị của Ddd là gam/ml nên ta cần đổi lại đơn vị để áp dụng công thức.
Sơ đồ tư duy: Nồng độ dung dịch