Tailieumoi.vn giới thiệu Giải bài tập Hóa học 8 Bài 38: Bài luyện tập 7, chi tiết nhất giúp học sinh dễ dàng làm bài tập Bài luyện tập lớp 8.
a) Hãy viết phương trình phản ứng hóa học xảy ra.
b) Các phản ứng hóa học trên thuộc loại phản ứng hóa học nào?
Lời giải:Phương trình phản ứng:
2K + 2H2O → 2KOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Phản ứng hóa học trên thuộc loại phản ứng thế (vì nguyên tử H trong H2Ođược thay thế bằng K hoặc Ca) và cũng là phản ứng oxi hóa khử
a) Na2O + H2O ---> NaOH
K2O + H2O ---> KOH
b) SO2 + H2O ---> H2SO3
SO3 + H2O ---> H2SO4
N2O5 + H2O ---> HNO3
c) NaOH + HCl ---> NaCl + H2O
Al(OH)3 + H2SO4 ---> Al2(SO4)3 + H2O
d) Chỉ ra sản phẩm ở a,b,c thuộc loại hợp chất nào? Nguyên nhân dẫn đến sự khác nhau về loại hợp chất của các sản phẩm ở đây a) và b) ?
e) Gọi tên các sản phẩm
Lời giải:a) Na2O + H2O → 2NaOH
K2O + H2O → 2KOH
b) SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
c) NaOH + HCl → NaCl + H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
d) Loại chất tạo ra ở câu a gồm NaOH, KOH là bazơ;
+ Loại chất tạo ra ở câu b gồm H2SO3, H2SO4, H2SO4 là axit,
+ Loại chất tạo ra ở câu c gồm NaCl, Al2(SO4)3 là muối.
Sự khác nhau giữa câu a và câu b là oxit của kim loại Na2O, K2O tác dụng với nước tạo thành bazơ, còn oxit của phi kim SO2, SO3, N2O5 tác dụng với nước tạo thành axit.
e) Gọi tên các sản phẩm
NaOH: natri hiđroxit
KOH: kali hiđroxit
H2SO3: axit sunfurơ
H2SO4: axit sunfuric
HNO3: axit nitric
NaCl: natri clorua
Al2(SO4)3: nhôm sunfat
Đồng (II) clorua, kẽm sunfat, sắt (III) sunfat, magie hiđrocacbonat, canxi photphat, natri hiđrophotphat, natri đihiđrophotphat.
Lời giải:Đồng (II) clorua: CuCl2
Kẽm sunfat: ZnSO4
Sắt (III) sunfat: Fe2(SO4)3
Magie hiđrocacbonat : Mg(HCO3)2
Canxi photphat: Ca3(PO4)2
Natri hiđrophotphat: Na2HPO4
Natri đihiđrophotphat: NaH2PO4
Khối lượng của kim loại có trong oxit kim loại: ( g/ mol)
Khối lượng nguyên tố oxi: mO = 160 – 112 = 48 (g/mol)
Đặt công thức hóa học của oxit kim loại là MxOy,( x, y € N*)
MKL. x = 112 => nếu x = 2 thì M = 56. Vậy M là Fe
16y = 48 => y = 3
Vậy CTHH: Fe2O3, đó là sắt (III) oxit
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính khối lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49 gam axit sunfuric nguyên chất tác dụng với 60 gam nhôm oxit. Sau phản ứng, chất nào còn dư? Khối lượng dư của chất đó là bao nhiêu?
Lời giải:Phương trình phản ứng hóa học:
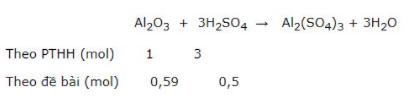
So sánh tỉ số ta thấy
Vậy axit H2SO4 phản ứng hết, Al2O3 dư. Mọi tính toán theo số mol của H2SO4 .
Theo PTHH:
Khối lượng muối nhôm sunfat được tạo thành là:
Lượng chất Al2O3 còn dư là: 60 – 17 =43 (g)
1. Thành phần hóa học định tính của nước: gồm hiđro và oxi
Thành phần định lượng: 1 phần H và 8 phần O
2. Nước tác dụng với
- Nước tác dụng với một số kim loại ở nhiệt độ thường (như Na, K, Ca…) tạo thành bazơ tan và khí hiđro;
- Tác dụng với một số oxit kim loại tạo thành bazơ tan như NaOH, KOH, Ca(OH)2;
- Tác dụng với một số oxit phi kim tạo ra axit như H2SO4, H2SO3
3. Phân tử axit gồm có 1 hay nhiều nguyên tử hiđro liên kết với gốc axit.
Công thức hóa học của axit gồm H và gốc axit.
4. Phân tử bazơ gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (-OH)
Công thức hóa học của bazơ gồm 1 nguyên tử kim loại và một số nhóm OH.
Tên bazơ = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị ) + hiđroxit
5. Phân tử muối gồm có nguyên tử kim loại liên kết với gốc axit.
Công thức hóa học của muối gồm kim loại và gốc axit.
Tên muối = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị )+ tên gốc axit.