Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Bài tập ôn tập cho học sinh giỏi lớp 12 có đáp án, chọn lọc môn Hóa học lớp, tài liệu bao gồm 100 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
ĐỀ CƯƠNG ÔN THI HỌC SINH GIỎI MÔN HOÁ 12 NĂM HỌC 2012-2013
A. KẾ HOẠCH ÔN THI
Tuần 1. Ôn tập cấu tạo nguyên tử- bảng tuần hoàn- liên kết hoá học
Tuần 2. Ôn tập các phản ứng trong hoá vô cơ.
Tuần 3. Ôn tập các dạng bài tập về lí thuyết phản ứng trong hoá vô cơ.
Tuần 4. Ôn tập các dạng bài tập về lí thuyết phản ứng trong hoá vô cơ(tiếp)
Tuần 5. Ôn tập một số dạng bài toán vô cơ: phản ứng của một số chất oxh mạnh: HNO3, H2SO4 đặc.
Tuần 6. Ôn tập một số dạng bài toán vô cơ: kim loại kiềm, kiềm thổ, nhôm, bài toán điện phân.
Tuần 7. Ôn tập các phản ứng trong hoá hữu cơ
Tuần 8. Các dạng bài tập về lí thuyết phản ứng trong hoá hữu cơ.
Tuần 9,10,11.Bài tập về các hợp chất hữu cơ: hiđrocacbon, ancol, phenol, ax cacboxylic, este, cacbohiđrat,amin, aminoax, peptit.
Tuần 12,13,14. Hướng dẫn học sinh làm bài tập trắc nghiệm và luyện một số đề thi trắc nghiệm.
Tuần 15. Hướng dẫn học sinh làm bài thi tự luận và luyện đề tổng hợp.
B. NỘI DUNG
Tuần 1.Ôn tập cấu tạo nguyên tử- bảng tuần hoàn- liên kết hoá học
I. Tóm tắt lí thuyết
II. Bài tập vận dụng
Chuyên đề cấu tạo nguyên tử- bảng tuần hoàn –liên kết hóa học
Bài 1. Hợp chất A có công thức là MXx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, X là phi kim ở chu kỳ 3. Biết trong hạt nhân nguyên tử của M có: n – p = 4, của X có n’ = p’ (trong đó n, n’, p, p’ là số nơtron và proton). Tổng số proton trong MXx là 58.
1. Xác định MXx ?
2. Hoà tan 1,2 gam A hoàn toàn vừa đủ trong dung dịch HNO3 0,36M thì thu được V lít khí màu nâu đỏ (đktc) và dung dịch B làm quỳ tím hoá đỏ.
Hãy xác định giá trị V và thể tích dung dịch HNO3 cần dùng.
Bài 2. Hợp chất A có công thức là MXx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, X là phi kim ở chu kỳ 3. Biết trong hạt nhân nguyên tử của M có: n – p = 4, của X có n’ = p’ (trong đó n, n’, p, p’ là số nơtron và proton). Tổng số proton trong MXx là 58.
1. Xác định MXx ?
2. Hoà tan 1,2 gam A hoàn toàn vừa đủ trong dung dịch HNO3 0,36M thì thu được V lít khí màu nâu đỏ (đktc) và dung dịch B làm quỳ tím hoá đỏ.
Hãy xác định giá trị V và thể tích dung dịch HNO3 cần dùng.
1. Xác định MXx ?
- Trong M có: n – p =4 n = p + 4
- Trong X có: n’ = p’
- Do electron có khối lượng không đáng kể nên: M = 2p + 4 (1)
X = x.2p’ (2)
- Theo đề bài: p’x + p = 58 (4)
- Giải (3), (4) p’x = 32, p = 26, n = 30
p = 26 nên M là Fe.
- Do x thuộc số nguyên dương:
Biện luận:
x 1 2 3 4 . . .
p’ 32 16 10,7 8
Kết luận Loại Nhận Loại Loại
X = 2, p’ = 16 nên X là S.
Vậy công thức của A là FeS2
2. Hãy xác định giá trị V và thể tích dung dịch HNO3 cần dùng:
Phương trình phản ứng:
FeS2 + 18HNO3 Fe(NO3)3 + 15NO2 + 2H2SO4 + 7H2O
0,01(mol) 0,18 0,15
V = 0,15.22,4 = 3,36(mol)
Bài 3.X và Y là các nguyên tố thuộc nhóm A, đều tạo hợp chất với hiđro có dạng RH (R là kí hiệu của nguyên tố X hoặc Y). Gọi A và B lần lượt là hiđroxit ứng với hóa trị cao nhất của X và Y. Trong B, Y chiếm 35,323% khối lượng. Trung hòa hoàn toàn 50 gam dung dịch A 16,8% cần 150 ml dung dịch B 1M. Xác định các nguyên tố X và Y.
Hợp chất với hiđro có dạng RH nên Y có thể thuộc nhóm IA hoặc VIIA.
Trường hợp 1 : Nếu Y thuộc nhóm IA thì B có dạng YOH
Ta có : (loại do không có nghiệm thích hợp)
Trường hợp 2 : Y thuộc nhóm VIIA thì B có dạng HYO4
Ta có : , vậy Y là nguyên tố clo (Cl).
B (HClO4) là một axit, nên A là một bazơ dạng XOH
XOH + HClO4 XClO4 + H2O
MX = 39 gam/mol, vậy X là nguyên tố kali (K).
Tuần 2,3. Ôn tập các dạng bài tập về lí thuyết phản ứng trong hoá vô cơ.
Bài 1. Chỉ dùng thêm phenolphtalein. Hãy phân biệt các dung dịch đựng riêng biệt sau: NaCl, NaHSO4, CaCl2, AlCl3, FeCl3, Na2CO3. (Viết phản ứng xảy ra ở dạng ion)
Bài 2. Nêu hiện tượng xảy ra và viết các phương trình phản ứng (nếu có) khi:
a) Cho Fe3O4 tác dụng với dung dịch HI dư.
b) Cho kim loại Al vào dung dịch hỗn hợp gồm KNO3 và KOH.
c) Cho dung dịch H2SO4 loãng vào dung dịch Fe(NO3)2.
d) Cho muối natri axetat vào dung dịch K2Cr2O7.
Bài 3. Cân bằng phản ứng oxi hoá- khử sau theo phương pháp thăng bằng electron:
a.FexSy + + + + NO + H2O
b. FeCl2 + KMnO4 + KHSO4
c. AlCl3 + KMnO4 + KHSO4
d. FeCO3 + KMnO4 + KHSO4
e. .
g.Cu2FeSx + O2 Cu2O + Fe3O4 +….
h. CH3-C6H4- C2H5 + KMnO4 + H2SO4
Bài 4. Viết phương trình phản ứng xảy ra trong các trường hợp sau:
(1) Dẫn khí O3 vào dung dịch KI. (2) Dẫn khí H2S vào dung dịch FeCl3.
(3) Trộn dung dịch KI với dung dịch FeBr3. (4) Dẫn khí Cl2 vào dung dịch NaOH.
(5) Dẫn khí SO2 vào dung dịch KMnO4. (6) Dẫn khí F2 vào nước nóng.
(7) Trộn dung dịch FeCl2 với dung dịch AgNO3 dư. (8) Dẫn khí SO2 và dung dịch H2S.
(9) Dẫn khí CO2 và dung dịch NaAlO2 ( Na[Al(OH)4).
(10) Cho dung dịch AlCl3 vào dung dịch Na2CO3
(11) Hoà tan hoàn toàn Fe2O3 trong dung dịch HI
(12) Sục khí CO2 vào dung dịch BaCl2
(13) Cho dung dịch NH3 dư vào dung dịch FeCl3
(14) Nhỏ dung dịch NaHSO4 vào dung dịch Ba(HCO3)2
(15) Hòa tan hoàn toàn hỗn hợp Cu, Fe2O3 trong dung dịch gồm NaNO3 và KHSO4.
(16) Nhiệt phân các chất sau: NH4NO3, NH4NO2, Fe(NO3)2, hỗn hợp FeCO3 và AgNO3(tỉ lệ mol 1: 3), K2Cr2O7, KMnO4, KClO3.
(17) Điện phân dung dịch NaCl không có màng ngăn.
Bài 5. a) Hoàn thành các phương trình phản ứng sau:
MnO2 + HCl Khí A; FeS + HCl Khí B
Na2SO3 + HCl Khí C; NH4HCO3 + NaOH Khí D
b) Cho khí A tác dụng với khí D; cho khí B tác dụng với khí C; cho khí B tác dụng với khí A trong nước. Viết các phương trình phản ứng xảy ra.
Bài 6. Cho các dung dịch riêng biệt mất nhãn sau: Na2SO4, AlCl3, FeSO4, NaHSO4, FeCl3. Chỉ dùng dung dịch K2S để nhận biết các dung dịch trên ngay ở lần thử đầu tiên. Viết các phương trình hoá học minh họa.
Bài 7. a) Hoàn thành các phương trình phản ứng sau:
KMnO4 + HCl Khí A FeS + HCl Khí B
Na2SO3+ H2SO4 Khí C NaCl + H2O dd D(điện phân màng ngăn)
b) Cho khí A tác dụng với dung dịch D, khí B tác dụng với khí C.
Cho khí C tác dụng với dung dịch D với tỉ lệ mol 1:1.
Viết phương trình phản ứng xảy ra.
Bài 8: Hợp chất A có dạng M3X2. Khi cho A vào nước, thu được kết tủa trắng B và khí C là một chất độc. Kết tủa B tan được trong dung dịch NaOH và dung dịch NH3. Đốt cháy hoàn toàn khí C rồi cho sản phẩm vào nước dư, thu được dung dịch axit D. Cho D từ từ vào dung dịch KOH, phản ứng xong thu được dung dịch E chứa 2 muối. Dung dịch E phản ứng với dung dịch AgNO3 cho kết tủa màu vàng F tan trong axit mạnh.
1/ Lập luận để chọn công thức hóa học đúng cho chất A. Viết các phương trình phản ứng xảy ra theo thứ tự từ A đến F. Biết M và X đều là những đơn chất phổ biến.
Bài 9: Viết phản ứng xảy ra trong các thí nghiệm sau:
1/ Cho từ từ dung dịch AlCl3 vào dung dịch NaOH cho đến dư
2/ Cho dung dịch FeCl3 lần lượt tác dung với Na2CO3; HI; H2S; K2S.
3/ Cho As2S3 tác dụng với HNO3 đặc nóng.
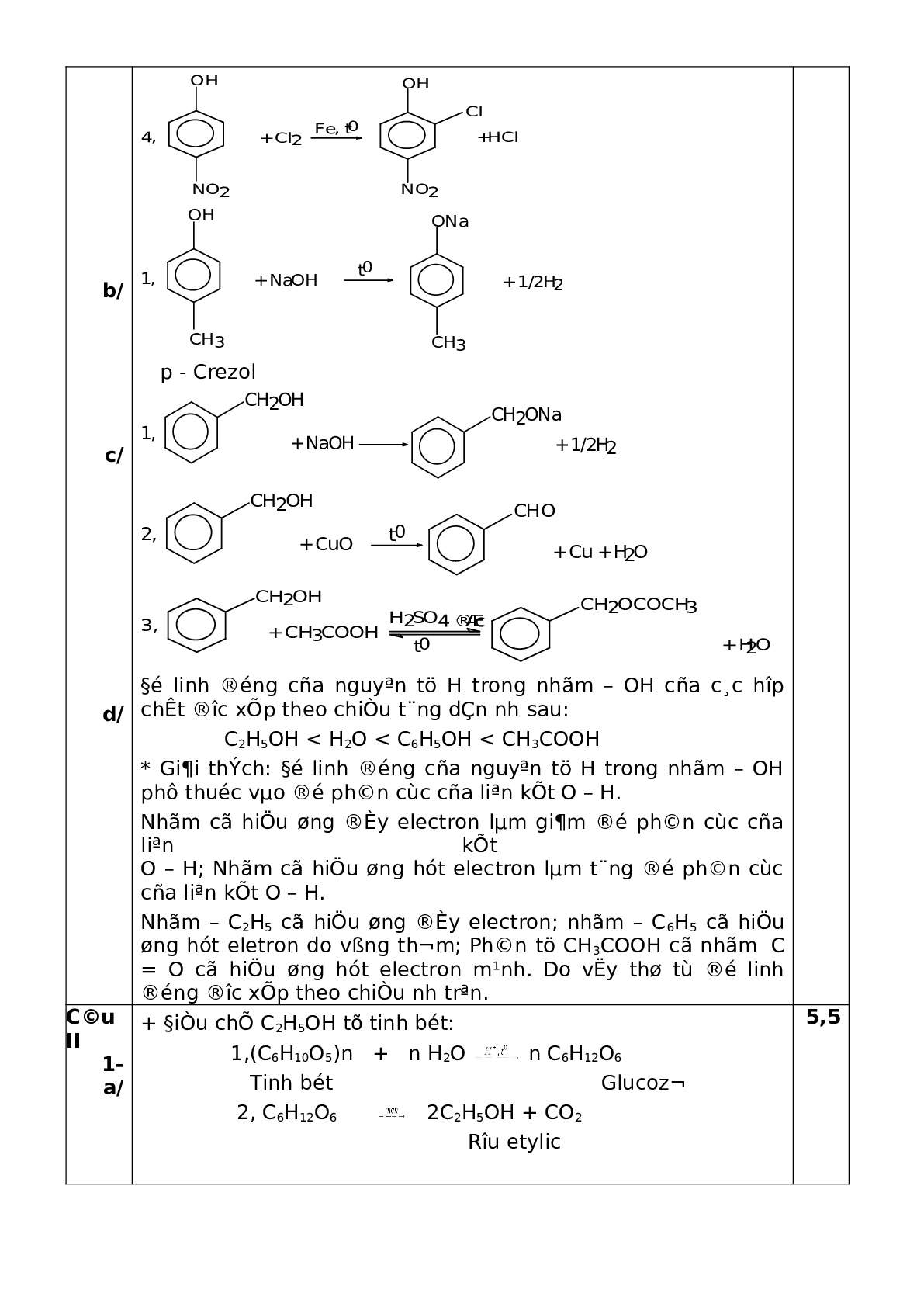
4/ Cho NH4Cl tác dụng với dung dịch NaAlO2; phenol tác dụng với natri cacbonat
Bài 10. Hãy nhận biết các lọ mất nhãn chứa các dung dịch sau : Na2CO3, Na2CO3, Na2SO4, NaHCO3, Ba(HCO3)2 , Pb(NO3)2.
Bài 11. Có các muối A,B,C ứng với các gốc axit khác nhau, cho biết :
A + dung dịch HCl có khí thoát ra
A + dung dịch NaOH có khí thoát ra
B + dung dịch HCl có khí thoát ra
B + dung dịch NaOH có kết tủa.
Ở dạng dung dịch C + A có khí thoát ra
Ở dạng dung dịch C + B có kết tủa và khí thoát ra
Xác định công thức phân tử của 3 muối, viết phương trình phản ứng.
Bài 12. Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây có thể dùng để điều chế những chất khí nào trong số các khí sau: Cl2, O2, NO, NH3, SO2, CO2, H2, C2H4, giải thích. Mỗi khí điều chế được, hãy chọn một cặp chất A và B thích hợp và viết phản ứng điều chế chất khí đó?
Bài 13. Xác định các chất A, B, C và hoàn thành 3 phản ứng sau:
NaBr + H2SO4 (đặc) Khí A + ........ (1)
NaI + H2SO4 (đặc) Khí B + ........ (2)
A + B C (rắn) +.... (3)
Bài 14.Sục khí A vào dung dịch chứa chất B ta được rắn C màu vàng và dung dịch D.
Khí X có màu vàng lục tác dụng với khí A tạo ra C và F. Nếu X tác dụng với khí A trong nước tạo ra Y và F, rồi thêm BaCl2 vào dung dịch thì có kết tủa trắng. A tác dụng với dung dịch chất G là muối nitrat kim loại tạo ra kết tủa H màu đen. Đốt cháy H bởi oxi ta được chất lỏng I màu trắng bạc.
Xác định A, B, C, F, G, H, I, X, Y và viết phương trình hóa học của các phản ứng.
Bài 15. Chỉ dùng chất chỉ thị phenolphtalein, hãy phân biệt các dung dịch đựng trong các lọ riêng biệt bị mất nhãn: NaHSO4, Na2CO3, AlCl3, Fe(NO3)3, NaCl, Ca(NO3)2. Viết các phương trình hoá học dưới dạng ion thu gọn.
Bài 16. Xác định các chất và hoàn thành sơ đồ biến hóa:
A X + D
X B Y +Z
C A + G
Bài 17. Viết phương trình phản ứng (dưới dạng phân tử) khi cho các dung dịch (mỗi dung dịch đều chứa 1 mol chất tan) tác dụng với nhau theo từng cặp sau: BaCl2 và NaHSO4; Ba(HCO3)2 và KHSO4; Ca(H2PO4)2 và KOH; Ca(OH)2 và NaHCO3.
Bài 18. Cho A, B, C, D, E là các muối vô cơ có gốc axit khác nhau. Xác định các chất A, B, C, D, E và viết phương trình hoá học để hoàn thành các phản ứng sau:
A + B + H2O có kết tủa và có khí thoát ra; C + B + H2O có kết tủa trắng keo.
D + B + H2O có kết tủa và khí; A + E có kết tủa.
E + B có kết tủa; D + Cu(NO3)2 có kết tủa (màu đen).
Bài 19. Chỉ dùng chất chỉ thị phenolphtalein, hãy phân biệt các dung dịch đựng trong các lọ riêng biệt bị mất nhãn: NaHSO4, Na2CO3, AlCl3, Fe(NO3)3, NaCl, Ca(NO3)2. Viết các phương trình hoá học minh họa dưới dạng ion thu gọn.