Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết và một số bài tập vận dụng tách, nhận biết các chất chương oxi-lưu huỳnh hóa 10, tài liệu gòm 6 trang có đầy đủ lý thuyết, ví dụ giải chi tiết và bài tập vận dụng, giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn hóa 10 sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
DẠNG 1: NHẬN BIẾT- TÁCH CHẤT
Các bước làm một bài nhận biết:
- Trích mẫu thử.
- Dùng thuốc thử.
- Nêu hiện tượng.
- Viết phương trình phản ứng.
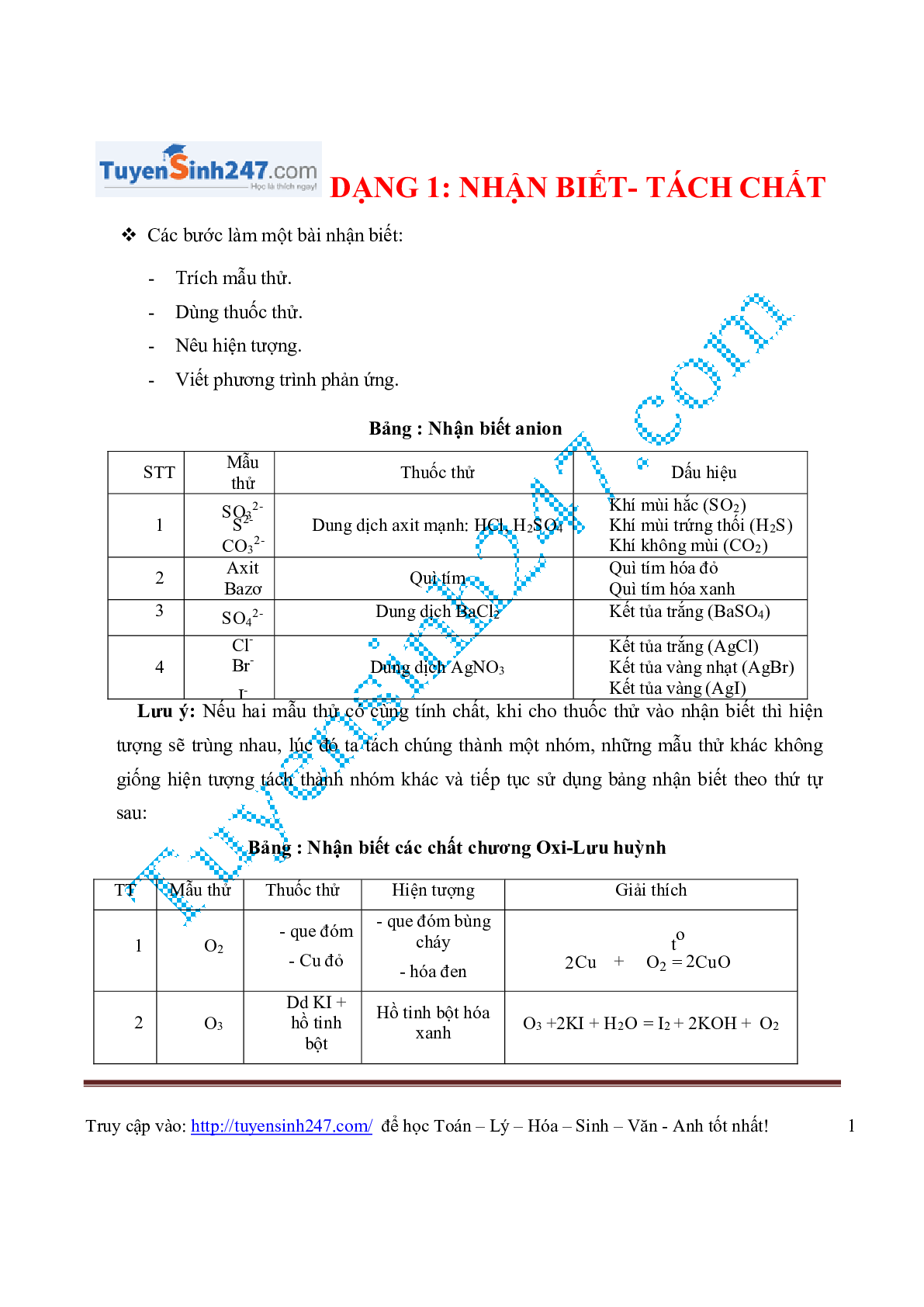
Bảng : Nhận biết anion
| STT | Mẫu thử |
Thuốc thử | Dấu hiệu |
| 1 | SO3 2- S2- CO3 2- |
Dung dịch axit mạnh: HCl, H2SO4 | Khí mùi hắc (SO2) Khí mùi trứng thối (H2S) Khí không mùi (CO2) |
| 2 | Axit Bazơ |
Quì tím | Quì tím hóa đỏ Quì tím hóa xanh |
| 3 | SO4 2- | Dung dịch BaCl2 | Kết tủa trắng (BaSO4) |
| 4 | Cl- Br- I- |
Dung dịch AgNO3 | Kết tủa trắng (AgCl) Kết tủa vàng nhạt (AgBr) Kết tủa vàng (AgI) |
Lưu ý: Nếu hai mẫu thử có cùng tính chất, khi cho thuốc thử vào nhận biết thì hiện
tượng sẽ trùng nhau, lúc đó ta tách chúng thành một nhóm, những mẫu thử khác không
giống hiện tượng tách thành nhóm khác và tiếp tục sử dụng bảng nhận biết theo thứ tự
sau:
Bảng : Nhận biết các chất chương Oxi-Lưu huỳnh
| TT | Mẫu thử | Thuốc thử | Hiện tượng | Giải thích |
| 1 | O2 | - que đóm - Cu đỏ |
- que đóm - Cu đỏ |
2Cu + O2 = 2CuO |
| 2 | O3 | 2Cu + O2 = 2CuO | Hồ tinh bột hóa xanh |
O3 +2KI + H2O = I2 + 2KOH + O2 |
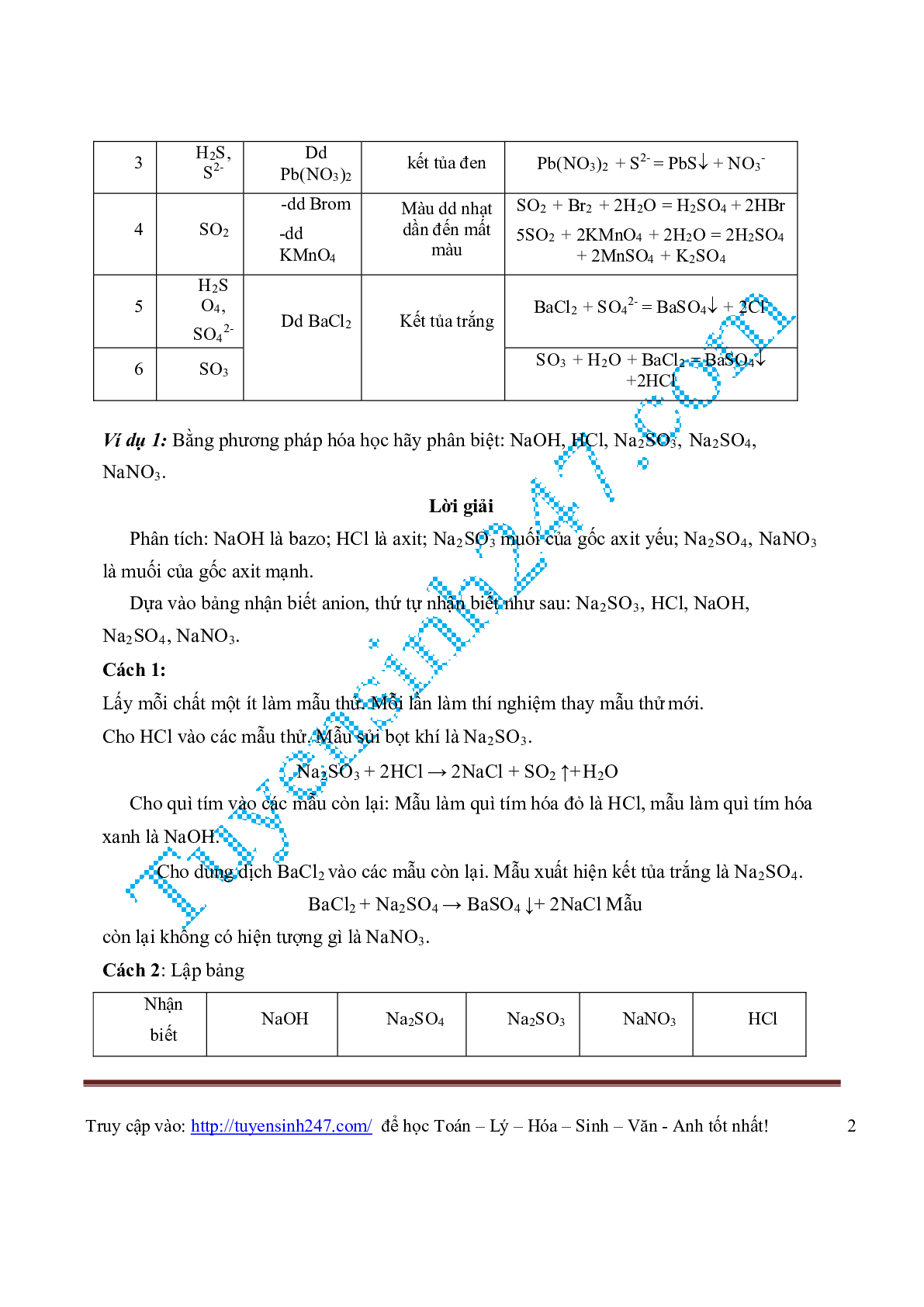
| 3 | H2S, S2- |
Dd Pb(NO3)2 |
kết tủa đen | Pb(NO3)2 + S2- = PbS + NO3- |
| 4 | SO2 | -dd Brom -dd KMnO4 |
Màu dd nhạt dần đến mất màu |
SO2 + Br2 + 2H2O = H2SO4 + 2HBr 5SO2 + 2KMnO4 + 2H2O = 2H2SO4 + 2MnSO4 + K2SO4 |
| 5 | H2S O4, SO4 2- |
Dd BaCl2 | Kết tủa trắng | BaCl2 + SO4 2- = BaSO4 + 2Cl- |
| 6 | SO3 | Dd BaCl2 | Kết tủa trắng | SO3 + H2O + BaCl2 = BaSO4 +2HCl |
Ví dụ 1: Bằng phương pháp hóa học hãy phân biệt: NaOH, HCl, Na2SO3, Na2SO4,
NaNO3.
Lời giải
Phân tích: NaOH là bazo; HCl là axit; Na2SO3 muối của gốc axit yếu; Na2SO4, NaNO3
là muối của gốc axit mạnh.
Dựa vào bảng nhận biết anion, thứ tự nhận biết như sau: Na2SO3, HCl, NaOH,
Na2SO4, NaNO3.
Cách 1:
Lấy mỗi chất một ít làm mẫu thử. Mỗi lần làm thí nghiệm thay mẫu thử mới.
Cho HCl vào các mẫu thử. Mẫu sủi bọt khí là Na2SO3.
Na2SO3 + 2HCl → 2NaCl + SO2 ↑+H2O
Cho quì tím vào các mẫu còn lại: Mẫu làm quì tím hóa đỏ là HCl, mẫu làm quì tím hóa
xanh là NaOH.
Cho dung dịch BaCl2 vào các mẫu còn lại. Mẫu xuất hiện kết tủa trắng là Na2SO4.
BaCl2 + Na2SO4 → BaSO4 ↓+ 2NaCl Mẫu
còn lại không có hiện tượng gì là NaNO3.
Cách 2: Lập bảng
| Nhận biết |
NaOH | Na2SO4 | Na2SO3 | NaNO3 | HCl |
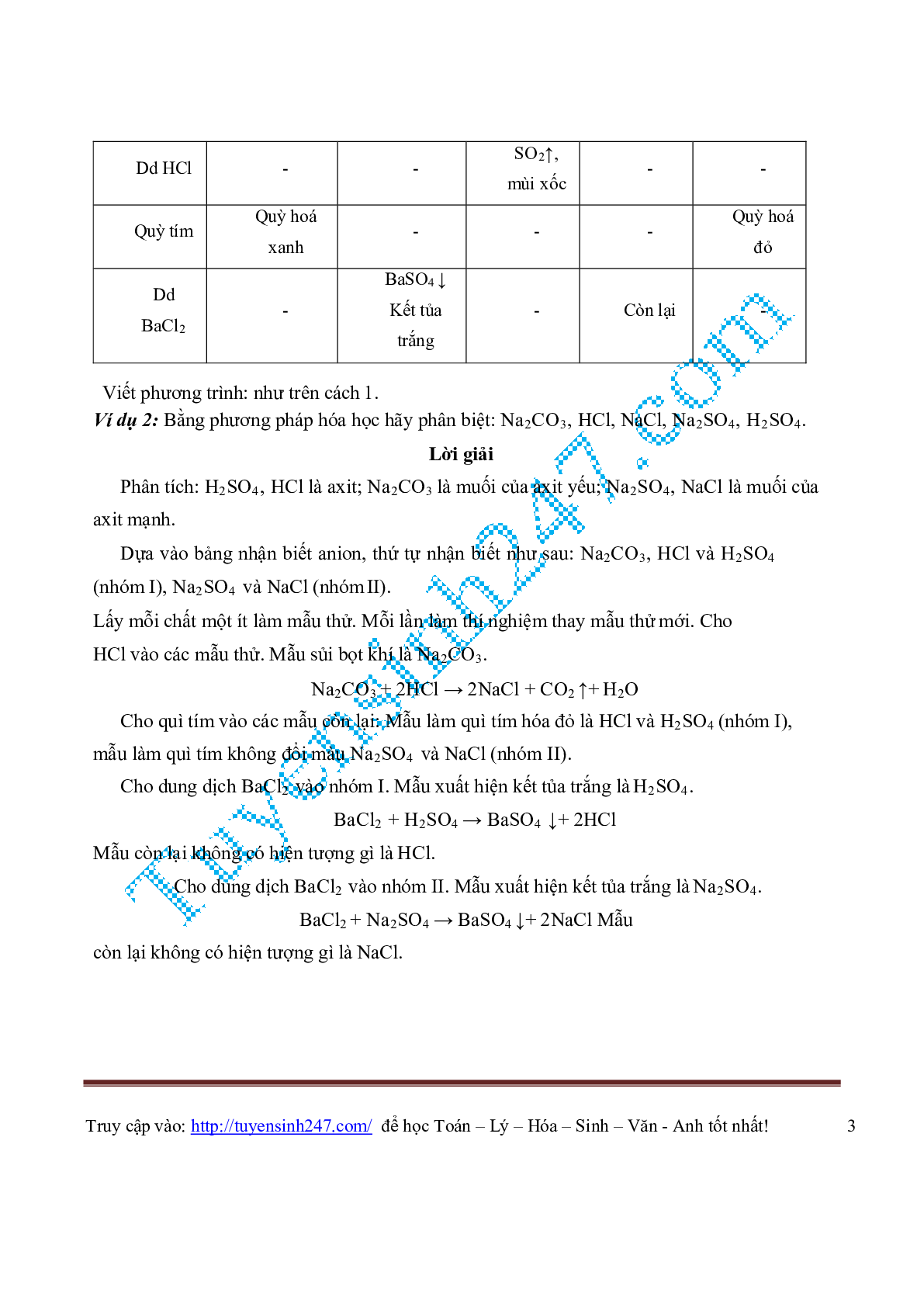
| Dd HCl | - | - | SO2↑, mùi xốc |
- | - |
| Quỳ tím | Quỳ hoá xanh |
- | - | - | Quỳ hoá đỏ |
| Dd BaCl2 |
- | BaSO4 ↓ Kết tủa trắng |
- | Còn lại | - |
Viết phương trình: như trên cách 1.
Ví dụ 2: Bằng phương pháp hóa học hãy phân biệt: Na2CO3, HCl, NaCl, Na2SO4, H2SO4.
Lời giải
Phân tích: H2SO4, HCl là axit; Na2CO3 là muối của axit yếu; Na2SO4, NaCl là muối của
axit mạnh.
Dựa vào bảng nhận biết anion, thứ tự nhận biết như sau: Na2CO3, HCl và H2SO4
(nhóm I), Na2SO4 và NaCl (nhómII).
Lấy mỗi chất một ít làm mẫu thử. Mỗi lần làm thí nghiệm thay mẫu thử mới. Cho
HCl vào các mẫu thử. Mẫu sủi bọt khí là Na2CO3.
Na2CO3 + 2HCl → 2NaCl + CO2 ↑+ H2O
Cho quì tím vào các mẫu còn lại: Mẫu làm quì tím hóa đỏ là HCl và H2SO4 (nhóm I),
mẫu làm quì tím không đổi màu Na2SO4 và NaCl (nhóm II).
Cho dung dịch BaCl2 vào nhóm I. Mẫu xuất hiện kết tủa trắng là H2SO4.
BaCl2 + H2SO4 → BaSO4 ↓+ 2HCl
Mẫu còn lại không có hiện tượng gì là HCl.
Cho dung dịch BaCl2 vào nhóm II. Mẫu xuất hiện kết tủa trắng là Na2SO4.
BaCl2 + Na2SO4 → BaSO4 ↓+ 2NaCl Mẫu
còn lại không có hiện tượng gì là NaCl.
BÀI TẬP ÁP DỤNG
Bài 1. Có 5 bình khí không màu, mất nhãn, mỗi bình đựng riêng biệt một trong các khí sau: O2;
O3; N2; SO2; CO. Hãy phân biệt các bình khí bằng phương pháp hóahọc.
Bài 2. Có 6 bình mất nhãn, mỗi bình chứa một trong các dung dịch sau: Na2SO4; H2SO4;
HCl; NaCl; BaCl2; NaOH. Hãy nhận biết các chất bằng PP hóa học.
Bài 3. Có 4 dung dịch loãng của các muối NaNO3, Pb(NO3)2, FeSO4, CuCl2. Hãy cho biết
hiện tượng gì xảy ra khi cho
a) dung dịch Na2S vào mỗi dung dịch muối trên?
b) khí H2S đi vào mỗi bình dung dịch muối trên?
Bài 4. Có 3 lọ không nhãn, mỗi lọ đựng một hỗn hợp dung dịch sau:
- Lọ 1: Dung dịch Na2CO3 và K2SO4 .
- Lọ 2: Dung dịch Na2SO3 và K2CO3 .
- Lọ 3: Dung dịch Na2SO4 và K2SO4 .
Trình bày phương pháp phân biệt 3 lọ trên mà chỉ dùng thuốc thử là dung dịch
HCl và Ba(NO3)2. Viết các phương trình hóa học của phản ứng xảy ra.
Bài 5. Hiện tượng gì xảy ra khi sục khí SO2 vào dung dịch đến dư :
a) Dung dịch Fe2(SO4)3 màu vàng nâu.
b) Dung dịch KMnO4 màu tím.
Bài 6 Viết PTHH của các phản ứng, cho biết hiện tượng xảy ra, vai trò chất tham gia (tính
oxi hóa) trong mỗi trường hợp sau:
- Dẫn khí H2S vào dung dịch hỗn hợp gồm KMnO4 vàH2SO4.
- Dẫn khí SO2 vào dung dịch Br2.
Bài 7. Trình bày phương pháp hóa học nhận biết các khí đựng trong các lọ riêng biệt sau: SO3;
SO2; CO2; CO và H2S.
Bài 8. Viết phương trình hóa học của phản ứng điều chế các chất: FeCl3, FeSO4 và Fe2(SO4)3
từ các hóa chất: FeS, NaCl, H2O và các chất xúc tác cần thiết, không dùng thêm hóa chất
Bài 9. Nêu nh ng hợp chất có thể điều chế H2S trong phòng thí nghiệm và nêu những
điểm cần lưu ý trong quá trình điều chế H2S.
Bài 10. Chỉ dùng thêm dung dịch BaCl2 hãy phân biệt bốn dung dịch mất nhãn sau :
NaCl, Na2SO4, Na2CO3, HCl được chứa trong các bình riêng biệt.
Bài 11. Chỉ dùng H2O và một hóa chất thích hợp để xác định các lọ hóa chất mất nhãn đựng
các chất sau: NaCl, BaSO3, Na2S, Na2SO3, Na2SO4, BaSO4.
Bài 12. Hãy dùng các hóa chất thích hợp để nhận biết các dd bị mất nhãn sau:
a) Na2S, Na2SO3, Na2SO4 , NaCl
b) NaOH, HCl, H2SO4, MgSO4, BaCl2
Bài 13. Không dùng thêm hóa chất nào khác. Hãy xác định các lọ hóa chất mất nhãn đựng
các dung dịch sau:
a) Cu(NO3)2, Na2S, BaCl2, Na2S
b) HCl, H2SO4, BaCl2, Na2SO3
Bài 14. Chỉ dùng quỳ tím, hãy xác định các lọ hóa chất mất nhãn đựng trong các lọ dung dịch
riêng biệt sau:
a) NaOH, Na2SO3, Na2SO4, H2SO4, MgSO4
b) Na2S, Na2SO3, Na2SO4, Ba(NO3)2, H2SO4
Bài 15. Dùng phương pháp hóa học để tinh chế
a) O2 có lẫn O3.
b) O2 có lẫn H2S, HCl, CO2.
Bài 16. Dùng phương pháp hóa học để làm sạch
a) Dung dịch HCl có lẫn H2SO4.
b) CaSO4 ở trạng thái rắn có lẫn CaCO3, Na2CO3.
Bài 17. Làm thế nào để thu được S tinh khiết từ hỗn hợp rắn: MgSO4, S, Zn, Fe.
Bài 18. Tách các chất ra khỏi hỗn hợp rắn: S, Na2SO4, Fe bằng phương pháp hóa học và vật lý?
Bài 19. Dùng phương pháp hóa học để tách các chất ra khỏi hỗn hợp rắn:
a) Na2SO4, S, Fe, CaSO3.
b) MgSO4, Na2SO4, S.
Bài 20. Từ Zn, S, HCl hãy viết các phương trình hóa học của phản ứng điều chế H2S bằng
hai phương pháp.