Tailieumoi.vn xin giới thiệu đến các quý thầy cô Giáo án Hóa học 10 bài 26: Luyện tập nhóm halogen mới nhất theo mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu này sẽ giúp thầy/cô dễ dàng biên soạn chi tiết Giáo án môn Hóa học lớp 10. Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Họ và tên:Nguyễn Thị Mai Anh – K67A
LUYỆN TẬP: NHÓM HALOGEN
Thời gian: 45 phút Lớp 10 chương trình cơ bản
I. MỤC TIÊU
a, Kiến thức
- Nêu được đặc điểm cấu tạo lớp electron ngoài cùng của nguyên tử halogen, cấu tạo phân tử của đơn chất halogen.
- Nêu được sự biến thiên tính chất của các đơn chất và hợp chất halogen khi đi từ flo đến iot.
- Viết được được nguyên tắc chung của phương pháp điều chế halogen.
- Vận dụng được cách nhận biết ion halogen
b, Kĩ năng
- Dùng số oxi hóa để giải thích được tính oxi hóa của halogen, tính oxi hóa mạnh của clo và hợp chất chủa clo.
- Viết các phương trình hóa học, chứng minh tính chất của đơn chất và hợp chất của halogen.
- Kĩ năng làm việc nhóm.
- Kĩ năng tự đánh giá.
c, Tình cảm, thái độ
- Yêu thích môn hóa học.
- HS có ý thức tích cực, tự giác vận dụng kiến thức đã học để giải thích các hiện tượng thực tế và giải các bài tập hóa học.
II. PHƯƠNG PHÁP DẠY HỌC
- PPDH theo hợp đồng kết hợp phương pháp thảo luận nhóm.
III. CHUẨN BỊ
- GV chuẩn bị phiếu hợp đồng, phiếu hỗ trợ (cắt dời các phiếu hỗ trợ cho mỗi nhiệm vụ), máy chiếu, các thẻ thông báo trợ giúp (thẻ đỏ (trợ giúp ), thẻ trắng (trao đổi với giáo viên) – mỗi bàn HS cần một bộ thẻ này.
- HS ôn tập lại kiến thức về halogen, axit clohidric,muối clorua và hợp chất có oxi của clo.
IV. CÁC HOẠT ĐỘNG DẠY HỌC
1. Ổn định lớp: Kiểm tra sĩ số, tác phong.
2. Bài giảng mới:
|
Hoạt động của giáo viên |
Hoạt động của học sinh |
|
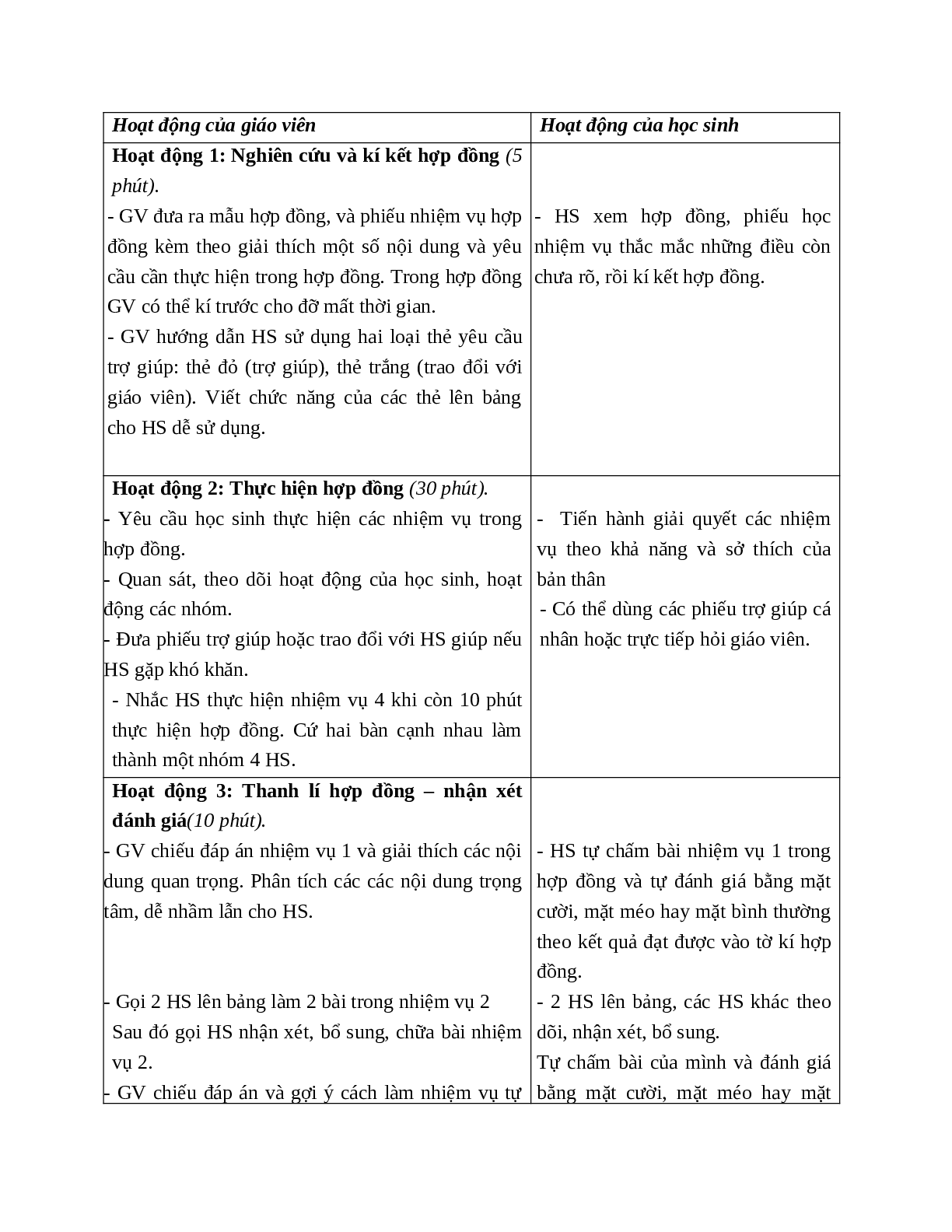
Hoạt động 1: Nghiên cứu và kí kết hợp đồng (5 phút). - GV đưa ra mẫu hợp đồng, và phiếu nhiệm vụ hợp đồng kèm theo giải thích một số nội dung và yêu cầu cần thực hiện trong hợp đồng. Trong hợp đồng GV có thể kí trước cho đỡ mất thời gian. - GV hướng dẫn HS sử dụng hai loại thẻ yêu cầu trợ giúp: thẻ đỏ (trợ giúp), thẻ trắng (trao đổi với giáo viên). Viết chức năng của các thẻ lên bảng cho HS dễ sử dụng.
|
- HS xem hợp đồng, phiếu học nhiệm vụ thắc mắc những điều còn chưa rõ, rồi kí kết hợp đồng.
|
|
Hoạt động 2: Thực hiện hợp đồng (30 phút). - Yêu cầu học sinh thực hiện các nhiệm vụ trong hợp đồng. - Quan sát, theo dõi hoạt động của học sinh, hoạt động các nhóm. - Đưa phiếu trợ giúp hoặc trao đổi với HS giúp nếu HS gặp khó khăn. - Nhắc HS thực hiện nhiệm vụ 4 khi còn 10 phút thực hiện hợp đồng. Cứ hai bàn cạnh nhau làm thành một nhóm 4 HS. |
- Tiến hành giải quyết các nhiệm vụ theo khả năng và sở thích của bản thân - Có thể dùng các phiếu trợ giúp cá nhân hoặc trực tiếp hỏi giáo viên. |
|
Hoạt động 3: Thanh lí hợp đồng – nhận xét đánh giá(10 phút). - GV chiếu đáp án nhiệm vụ 1 và giải thích các nội dung quan trọng. Phân tích các các nội dung trọng tâm, dễ nhầm lẫn cho HS.
- Gọi 2 HS lên bảng làm 2 bài trong nhiệm vụ 2 Sau đó gọi HS nhận xét, bổ sung, chữa bài nhiệm vụ 2. - GV chiếu đáp án và gợi ý cách làm nhiệm vụ tự chọn 3. - Gọi đại diện một nhóm trả lời nhiệm vụ 4 Sau đó các nhóm khác nhận xét, bổ sung. - Tổng kết bài học: GV chốt lại một số vấn đề quan trọng kiến thức cơ bản của bài học. - Yêu cầu HS nộp các bản hợp đồng có kèm phiếu bài tập đã làm. |
- HS tự chấm bài nhiệm vụ 1 trong hợp đồng và tự đánh giá bằng mặt cười, mặt méo hay mặt bình thường theo kết quả đạt được vào tờ kí hợp đồng. - 2 HS lên bảng, các HS khác theo dõi, nhận xét, bổ sung. Tự chấm bài của mình và đánh giá bằng mặt cười, mặt méo hay mặt bình thường theo kết quả đạt được vào tờ kí hợp đồng.
- HS nào làm được so sánh kết quả, HS chưa làm có thể ghi đáp số và hướng dẫn để về nhà làm.
- Tự chấm bài của mình và đánh giá bằng mặt cười, mặt méo hay mặt bình thường theo kết quả đạt được vào tờ kí hợp đồng. |
Hoạt động 4: Hướng dẫn học ở nhà
Mục tiêu:
- HS áp dụng được kiến thức để làm bài tập.
- Rèn ý thức học bài và làm bài của HS
Phát phiếu bài tập cho HS về nhà làm:
Bài 1: Dùng Clo để khử trùng nước sinh hoạt là một phương pháp rẻ tiền và dễ sử dụng. Tuy nhiên, cần phải thường xuyên kiểm tra nồng độ clo dư ở trong nước bởi vì lượng clo dư sẽ gây nguy hiểm cho con người và môi trường. Cách đơn giản để kiểm tra lượng clo dư là dung kali iotua và hồ tinh bột. Hãy nêu hiện tượng của quá trình này và viết phương trình hóa học (nếu có).
Bài 2 : Cân bằng các phản ứng oxi hóa – khử sau:
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
b) KClO3 + HCl → KCl + Cl2 + H2O
c) KOH + Cl2 → KCl + KClO3 + H2O
d) Cl2 + SO2 + H2O → HCl + H2SO4
e) Fe3O4 + HCl → FeCl2 + FeCl3 + H2O
f) CrO3 + HCl → CrCl3 + Cl2 + H2O
g) Cl2 + Ca(OH)2 → CaCl2 + Ca(OCl)2 + H2O
- Làm bài tập trong sách giáo khoa và sách bài tập cơ bản.
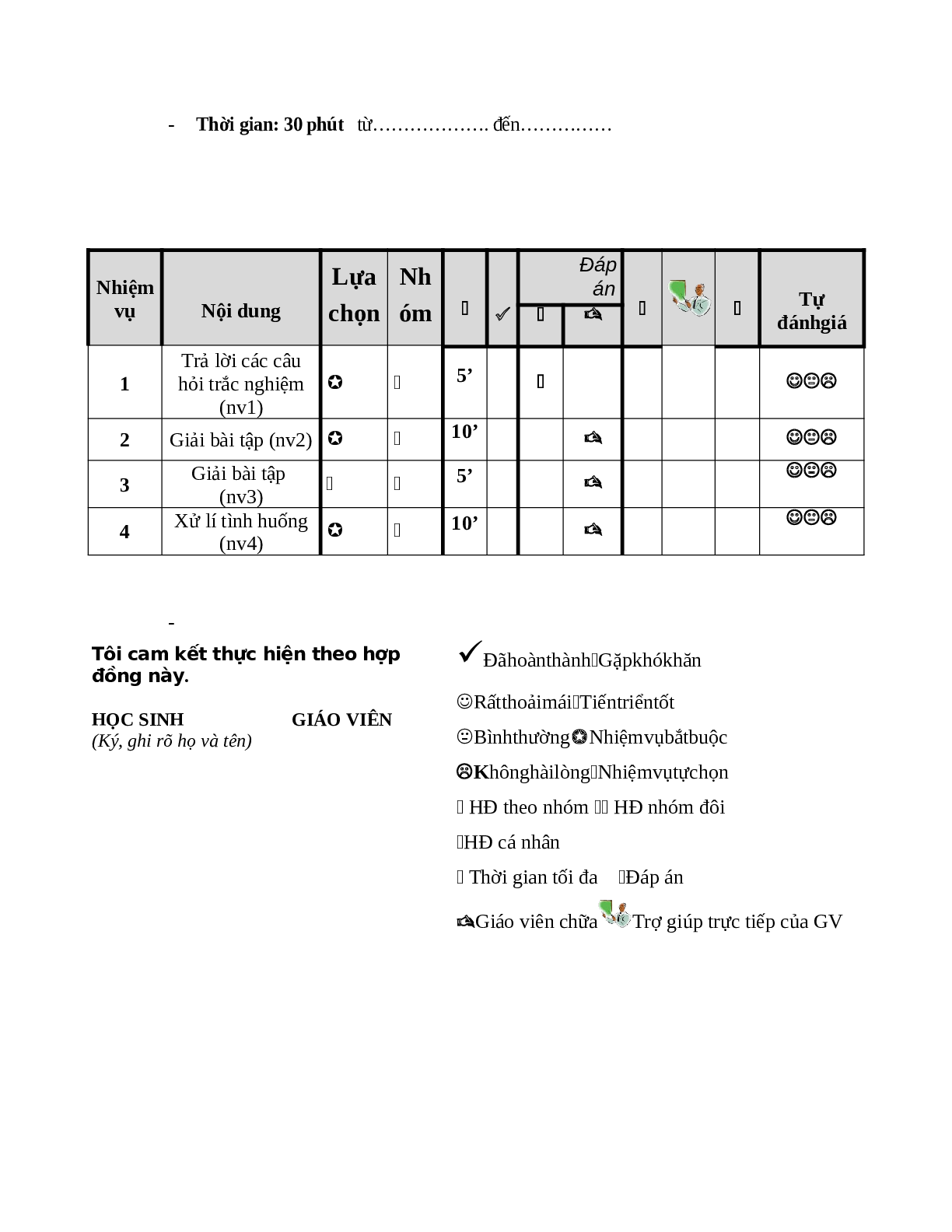
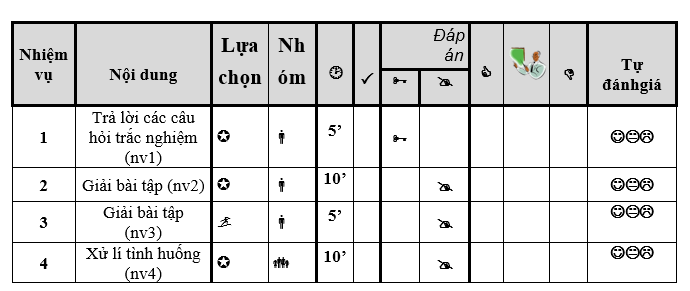
HỢP ĐỒNG BÀI LUYỆN TẬP CHƯƠNG 6
- Họ và tên HS:.................................................. .................................................................. Lớp:....................Trường:............................................................................................................
- Thời gian: 30 phút từ………………. đến……………

PHIẾU HỌC TẬP
NHIỆM VỤ 1:Áp dụng làm bài tập 1,2,3,4,5 (bắt buộc --5 phút)
Câu 1:Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là:
A. ns2np4.
B. ns2p5.
C. ns2np3.
D. ns2np6.
Câu 2:Ở trạng thái cơ bản các nguyên tố halogen có mấy e độc thân?
A. 1
B. 5.
C. 3.
D. 7.
Câu 3:Liên kết trong các phân tử đơn chất halogen là gì?
A. cộng hóa trị không cực.
B. cộng hóa trị có cực.
C. liên kết ion.
D. liên kết cho nhận.
Câu 4: Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã
nhận hay nhường bao nhiêu electron?
A. Nhận thêm 1 electron
B. Nhận thêm 2 electron
C. Nhường đi 1 electron
D. Nhường đi 7 electron
Câu 5: Nhận xét nào sau đây về liên kết trong phân tử các halogen là không chính xác ?
A. Liên kết công hóa trị.
B. Liên kết phân cực.
C. Liên kết đơn.
D. Tạo thành bằng sử dụng chung một đôi electron.
NHIỆM VỤ 2: Áp dụng làm bài tập 1,2 (bắt buộc --10 phút)
Bài 1: Hòa tan 7,8 gam hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch tăng thêm 7,0 gam. Khối lượng nhôm và magie trong hỗn hợp đầu là bao nhiêu gam?
Bài 2: Có hỗn hợp gồm hai muối NaCl và NaBr. Khi cho dung dịch AgNO3 vừa đủ vào hỗn hợp trên người ta thu được lượng kết tủa bằng khối lượng AgNO3 tham gia phản ứng. Tìm % khối lượng mỗi muối trong hỗn hợp ban đầu.
Bài giải:
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….................................
NHIỆM VỤ 3: Giải bài tập sau ( tự chọn-- 5 phút)
Từ một tấn muối ăn có chứa 10,5% tạp chất, người ta điều chế được 1250 lit dung dịch HCl 37% (D = 1,19 g/ml) bằng cách cho lượng muối ăn trên tác dụng với axit sunfuric đậm đặc và đun nóng. Tính hiệu suất của quá trình điều chế trên.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
NHIỆM VỤ 4: Thảo luận nhóm xử lí tình huống sau (hai bàn cạnh nhau làm thành một nhóm) (bắt buộc- -10 phút)
Một loại muối ăn có lẫn tạp chất CaCl2, MgCl2, Na2SO4, MgSO4, CaSO4. Hãy trình bày cách loại các tạp chất để thu được muối ăn tinh khiết.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
PHIẾU HỖ TRỢ NHIỆM VỤ
|
Nhiệm vụ 2: Bài 1: 2Al + 6HCl 2AlCl3 + 3H2 (1) x 1,5x (mol) Mg + 2HCl MgCl2 + H2 (2) y y (mol) Đặt x, y lần lượt là số mol của Al và Mg trong hỗn hợp. 1 phương trình từ khối lượng hỗn hợp. 1 phương trình từ tăng giảm khối lượng trong dung dịch. Giải ra ta được x , y Tìm được mAl và mMg .
Bài 2: NaCl + AgNO3 AgCl + NaNO3 a a a (mol) NaBr + AgNO3 AgBr + NaNO3 b b b (mol) Từ dữ liệu khối lượng kết tủa bằng khối lượng AgNO3 tham gia phản ứng biến đổi ra: Tìm được % NaCl và NaBr
|
|
Nhiệm vụ 3: Lượng NaCl nguyên chất: 1000kg * (100 – tạp chất)% = 895kg Lượng HCl thu được theo lí thuyết : 2NaCl + H2SO4 Na2SO4 + 2HCl 58,5 g 36,5g 895kg x = ?kg Lượng HCl thu được theo thực tế: 1250 lit x D(kg/lit) x 37% = kg Hiệu suất của quá trình điều chế: H% = x 100% = %
|
|
Nhiệm vụ 4: -Hòa tan muối ăn vào nước cất. - Thêm BaCl2 dư để loại ion SO42- ở dạng BaSO4 kết tủa trắng, - Lọc bỏ kết tủa BaSO4. - Thêm Na2CO3 dư để loại ion Mg2+ , Ca2+ , Ba2+ dư . - Lọc bỏ kết tủa MgCO3, CaCO3, BaCO3. - Thêm dung dịch HCl để loại bỏ Na2CO3 dư. - Cô cạn dung dịch ta thu được muối ăn tinh khiết.
|
ĐÁP ÁN PHẦN NHIỆM VỤ 1: 1 – B, 2- D, 3- A, 4- A, 5 – B.