Với tóm tắt lý thuyết Hóa học lớp 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học lớp 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Video giải Hóa học 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì - Kết nối tri thức
A. Lý thuyết Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
I. Thành phần của các oxide và hydroxide
Hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố fluorine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì.
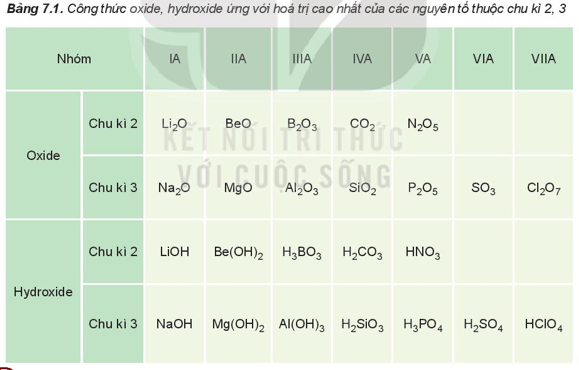
Ví dụ: Nguyên tố calcium thuộc nhóm IIA của bảng tuần hoàn. Viết công thức hóa học của oxide, hydroxide (ứng với hóa trị cao nhất) của nguyên tố trên.
Hướng dẫn giải:
Nguyên tố calcium (Ca) thuộc nhóm IIA.
Hóa trị cao nhất của Ca là II.
Công thức hóa học của oxide là CaO, của hydroxide là Ca(OH)2.
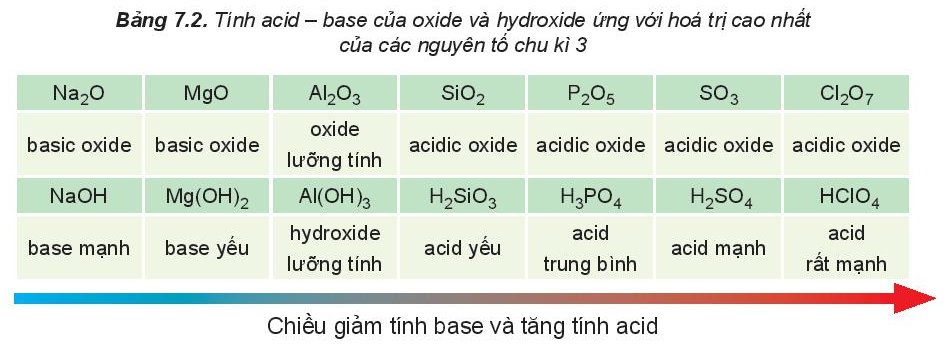
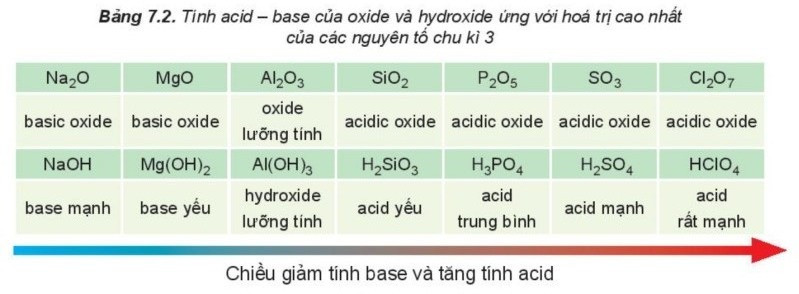
II. Tính chất của oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Nhận xét:
Hydroxide của các nguyên tố nhóm IA thể hiện tính base mạnh, hydroxide ứng với hóa trị cao nhất của các nguyên tố nhóm VIIA (trừ fluorine) thể hiện tính acid mạnh.
Ví dụ: Cho các nguyên tố P (Z = 15), S (Z = 16), Cl (Z = 17). So sánh tính acid của hydroxide (ứng với hóa trị cao nhất) của các nguyên tố trên.
Hướng dẫn giải:
P (Z = 15): [Ne]3s23p3 P thuộc chu kì 3, nhóm VA.
Hóa trị cao nhất của P là V Công thức hydroxide (ứng với hóa trị cao nhất) là H3PO4.
S (Z = 16): [Ne]3s23p4 S thuộc chu kì 3, nhóm VIA.
Hóa trị cao nhất của S là VI Công thức hydroxide (ứng với hóa trị cao nhất) là H2SO4.
Cl (Z = 17): [Ne]3s23p5 Cl thuộc chu kì 3, nhóm VA.
Hóa trị cao nhất của Cl là VII Công thức hydroxide (ứng với hóa trị cao nhất) là HClO4.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
So sánh tính acid: H3PO4 < H2SO4 < HClO4.
B. Trắc nghiệm Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Câu 1. Oxide nào sau đây tan trong nước tạo thành dung dịch làm đổi màu quỳ tím thành đỏ?
A. Na2O.
B. MgO.
C. CaO.
D. P2O5.
Đáp án: D
Giải thích:
Oxide P2O5 tan hoàn toàn trong nước tạo dung dịch có tính acid làm quỳ tím chuyển màu đỏ.
Phương trình hóa học: P2O5 + 3H2O 2H3PO4.
Chú ý:
+ Na2O, CaO tan toàn toàn trong nước, dung dịch sau phản ứng làm quỳ tím chuyển màu xanh.
Phương trình hóa học:
Na2O + H2O 2NaOH
CaO + H2O Ca(OH)2
+ MgO tan một phần trong nước, dung dịch sau phản ứng làm quỳ tím chuyển màu xanh nhạt.
Câu 2. Thêm từng giọt Na2CO3 vào ống nghiệm chứa dung dịch HNO3. Nêu hiện tượng quan sát được.
A. Xuất hiện kết tủa trắng.
B. Dung dịch chuyển sang màu vàng nhạt.
C. Có khí thoát ra.
D. Không có hiện tượng gì.
Đáp án: C
Giải thích:
Hiện tượng: Có khí thoát ra.
Phương trình hóa học:
Na2CO3 + 2HNO3 2NaNO3 + CO2 + H2O.
Câu 3. Hydroxide của các nguyên tố nhóm IA thể hiện
A. tính acid mạnh.
B. tính acid yếu.
C. tính base mạnh.
D. tính base yếu.
Đáp án: C
Giải thích:
Hydroxide của các nguyên tố nhóm IA thể hiện tính base mạnh.
Ví dụ: NaOH, KOH.
Câu 4. Hydroxide ứng với hóa trị cao nhất của các nguyên tố nhóm VIIA (trừ fluorine) thể hiện
A. tính acid mạnh.
B. tính base mạnh.
C. tính acid yếu.
D. tính base yếu.
Đáp án: A
Giải thích:
Hydroxide ứng với hóa trị cao nhất của các nguyên tố nhóm VIIA (trừ fluorine) thể hiện tính acid mạnh.
Ví dụ: HClO4.
Câu 5. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân,
A. tính base của oxide và hydroxide tương ứng tăng dần, đồng thời tính acid của chúng giảm dần.
B. tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
C. tính acid, base của oxide và hydroxide tương ứng tăng dần.
D. tính acid, base của oxide và hydroxide tương ứng giảm dần.
Đáp án: B
Giải thích:
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Câu 6. Khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố flourine ở chu kì 2), hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen
A. tăng từ I đến VII.
B. giảm từ VII đến I.
C. tăng từ II đến VIII.
D. giảm từ VIII đến II.
Đáp án: A
Giải thích:
Hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố fluorine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì.
Câu 7. Nguyên tố magnesium thuộc nhóm IIA của bảng tuần hoàn. Công thức hóa học của oxide, hydroxide (ứng với hóa trị cao nhất) của nguyên tố trên lần lượt là:
A. MgO; MgOH.
B. Mg2O; MgOH.
C. MgO; Mg(OH)2.
D. MgO2; Mg2O
Đáp án: C
Giải thích:
Nguyên tố magnesium (Mg) thuộc nhóm IIA.
Hóa trị cao nhất của Mg là II.
Công thức hóa học của oxide là MgO, của hydroxide là Mg(OH)2.
Câu 8. Nguyên tố chlorine thuộc nhóm VIIA của bảng tuần hoàn. Công thức hóa học của oxide, hydroxide (ứng với hóa trị cao nhất) của nguyên tố trên lần lượt là:
A. Cl2O3; HClO3.
B. Cl2O5; HClO4.
C. Cl2O7; HClO4.
D. ClO4; HClO.
Đáp án: C
Giải thích:
Nguyên tố chlorine (Cl) thuộc nhóm VIIA.
Hóa trị cao nhất của Cl là VII.
Công thức hóa học của oxide là Cl2O7, của hydroxide là HClO4.
Câu 9. Phát biểu nào sau đây là đúng?
A. Thành phần của oxide và hydroxide có sự lặp lại theo chu kì.
B. Thành phần của oxide và hydroxide không có sự lặp lại theo chu kì.
C. Thành phần của oxide có sự lặp lại theo chu kì, thành phần của hydroxide không có sự lặp lại theo chu kì.
D. Thành phần của oxide không có sự lặp lại theo chu kì, thành phần của hydroxide có sự lặp lại theo chu kì.
Đáp án: A
Giải thích:
Hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố fluorine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì.
Câu 10. Cho oxide Na2O vào nước, nhúng giấy quỳ tím vào dung dịch sau phản ứng. Nêu hiện tượng xảy ra.
A. Na2O tan hoàn toàn trong nước, quỳ tím chuyển màu đỏ.
B. Na2O tan hoàn toàn trong nước, quỳ tím chuyển màu xanh đậm.
C. Na2O tan một phần trong nước, quỳ tím chuyển màu đỏ.
D. Na2O tan một phần trong nước, quỳ tím chuyển màu xanh nhạt.
Đáp án: B
Giải thích:
Hiện tượng: Na2O tan hoàn toàn trong nước tạo thành dung dịch base mạnh ® quỳ tím chuyển màu xanh đậm.
Phương trình hóa học: Na2O + H2O 2NaOH.
Câu 11. Cho các nguyên tố Si (Z = 14), S (Z = 16), Cl (Z = 17). So sánh tính acid của hydroxide (ứng với hóa trị cao nhất) của các nguyên tố trên theo chiều tăng dần.
A. H2SiO3 < HClO4 < H2SO4.
B. H2SO4 < H2SiO3 < HClO4.
C. H2SiO3 < H2SO4 < HClO4.
D. H2SO4 < HClO4 < H2SiO3.
Đáp án: C
Giải thích:
Si (Z = 14): [Ne]3s23p2 Si thuộc chu kì 3, nhóm IVA.
Hóa trị cao nhất của Si là IVCông thức hydroxide (ứng với hóa trị cao nhất) là H2SiO3.
Si (Z = 16): [Ne]3s23p4 S thuộc chu kì 3, nhóm VIA.
Hóa trị cao nhất của S là VI Công thức hydroxide (ứng với hóa trị cao nhất) là H2SO4.
Cl (Z = 17): [Ne]3s23p5 Cl thuộc chu kì 3, nhóm VIIA.
Hóa trị cao nhất của Cl là VII Công thức hydroxide (ứng với hóa trị cao nhất) là HClO4.
|
Nhóm |
IVA |
VIA |
VIIA |
|
|
Hydroxide |
Chu kì 3 |
H2SiO3 |
H2SO4 |
HClO4 |
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
So sánh tính acid: H2SiO3 < H2SO4 < HClO4.
Câu 12. Cho các oxide sau: Na2O, MgO, Al2O3; SiO2. Trong các oxide trên, oxide có tính base mạnh nhất là
A. Na2O.
B. MgO.
C. Al2O3.
D. SiO2.
Đáp án: A
Giải thích:
|
Nhóm |
IA |
IIA |
IIIA |
IVA |
|
|
Oxide |
Chu kì 3 |
Na2O |
MgO |
Al2O3 |
SiO2 |
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
So sánh tính base: Na2O > MgO > Al2O3 > SiO2.
Câu 13. Những đại lượng và tính chất nào của nguyên tố hóa học cho dưới đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Tính kim loại và phi kim.
B. Tính acid – base của các hydroxide.
C. Khối lượng nguyên tử.
D. Cấu hình electron lớp ngoài cùng của nguyên tử.
Đáp án: C
Giải thích:
Những đại lượng và tính chất của nguyên tố hóa học biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Tính kim loại và phi kim.
+ Tính acid – base của các hydroxide.
+ Cấu hình electron lớp ngoài cùng của nguyên tử.
Khối lượng nguyên tử không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Câu 14. Trong các chất dưới đây, chất nào có tính acid mạnh nhất?
A. HClO4.
B. H3PO4.
C. H2SiO3.
D. H2SO4.
Đáp án: A
Giải thích:
|
Nhóm |
IVA |
VA |
VIA |
VIIA |
|
|
Hydroxide |
Chu kì 3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide và hydroxide tương ứng của chúng tăng dần.
So sánh tính acid: H2SiO3 < H3PO4 < H2SO4 < HClO4.
Câu 15. Phát biểu nào sau đây là đúng?
A. Các oxide, hydroxide ứng với hóa trị cao nhất của các nguyên tố chu kì 3 chỉ có tính base.
B. Các oxide, hydroxide ứng với hóa trị cao nhất của các nguyên tố chu kì 3 chỉ có tính acid.
C. Các oxide, hydroxide ứng với hóa trị cao nhất của các nguyên tố chu kì 3 có tính base hoặc acid hoặc lưỡng tính.
D. Các oxide, hydroxide ứng với hóa trị cao nhất của các nguyên tố chu kì 3 có tính lưỡng tính.
Đáp án: C
Giải thích:
Các oxide, hydroxide ứng với hóa trị cao nhất của các nguyên tố chu kì 3 có tính base hoặc acid hoặc lưỡng tính.
Bài giảng Hóa học 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì - Kết nối tri thức
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Chương 2: Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn