Tài liệu Bộ 40 đề thi Hóa học lớp 8 Giữa học kì 2 có đáp án năm học 2024 - 2025 gồm 40 đề thi tổng hợp từ đề thi môn Hóa học 8 của các trường THCS trên cả nước đã được biên soạn đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Giữa học kì 2 Hóa học lớp 8. Mời các bạn cùng đón xem:
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 1)
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành đỏ?
A. H3PO4, HNO3, HCl, NaCl, H2SO4
B. H3PO4, HNO3, KCl, NaOH, H2SO4
C. H3PO4, HNO3, HCl, H3PO3, H2SO4
D. H3PO4, KNO3, HCl, NaCl, H2SO4
Câu 2: Cho các phản ứng sau
1) Cu + 2AgNO3 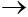 Cu(NO3)2 + 2Ag
Cu(NO3)2 + 2Ag
2) Na2O + H2O 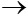 2NaOH
2NaOH
3) Fe + 2HCl 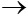 FeCl2 + H2
FeCl2 + H2
4) CuO+ 2HCl 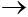 CuCl2 + H2O
CuCl2 + H2O
5) 2Al + 3H2SO4 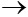 Al2(SO4)3 + 3H2
Al2(SO4)3 + 3H2
6) Mg + CuCl2 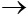 MgCl2 + Cu
MgCl2 + Cu
7) CaO + CO2 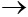 CaCO3
CaCO3
8) HCl+ NaOH 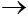 NaCl+ H2O
NaCl+ H2O
Số phản ứng thuộc loại phản ứng thế là:
A. 3 B. 4 C. 5 D. 6
Câu 3: Dãy các chất gồm toàn oxit axit là:
A. MgO, SO2
B. CaO, SiO2
C. P2O5, CO2
D. FeO, ZnO
Câu 4: Phương pháp điều chế khí oxi trong phòng thí nghiệm là:
A. Đun nóng KMnO4 hoặc KClO3 ở nhiệt độ cao
B. Đi từ không khí
C. Điện phân nước
D. Nhiệt phân CaCO3
Câu 5: Cho các oxit: CaO; Al2O3; N2O5; CuO; Na2O; BaO; MgO; P2O5; Fe3O4; K2O. Số oxit tác dụng với nước tạo bazơ tương ứng là:
A. 3 B. 4 C. 5 D. 2
Câu 6: Cho 11,2 gam Fe vào dung dịch chứa 0,25 mol H2SO4. Thể tích khí thu được ở đktc là:
A. 4,48 lít B. 5,6 lít C. 8,96 lít D. 11,2 lít
II. TỰ LUẬN (7 điểm)
Câu 1: Hoàn thành các phương trình hóa học sau:
a) CH4 + O2 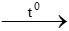
b) P + O2 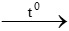
c) CaCO3 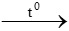
d) H2 + CuO 
Câu 2: Cho các oxit có công thức: Fe2O3, MgO, CO2, SO3, P2O3, K2O, NO2
Cho biết đâu là oxit bazơ, đâu là oxit axit và gọi tên các oxit trên.
Câu 3: Dùng khí hidro để khử hết 50g hỗn hợp A gồm đồng(II) oxit và sắt(III) oxit. Biết trong hỗn hợp sắt(III) oxit chiếm 80% khối lượng.
a) Viết các phương trình hóa học
b) Tính thể tích khí H2 cần dùng ở đktc.

HƯỚNG DẪN CHẤM
ĐỀ THI GIỮA HỌC KỲ II – ĐỀ 1
MÔN: HÓA HỌC 8
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1: Đáp án C
Dãy các dung dịch axit làm quì chuyển thành đỏ
Câu 2 : Đáp án B
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.Nên các phản ứng thế là: 1,3,5,6
Câu 3: Đáp án C
Câu 4: Đáp án A
Trong phòng thí nghiệm, khí oxi đươc điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như KMnO4 và KClO3
Câu 5: Đáp án B
Oxit bazơ tác dụng với nước tạo bazơ tương ứng: CaO; Na2O; BaO; K2O
Câu 6: Đáp án A
Fe + H2SO4  FeSO4 + H2
FeSO4 + H2
nFe = 11,2 : 56 = 0,2 mol
nH2SO4 = 0,25 mol
Vì 0,2 :1 < 0,25 : 1 => Fe là chất hết, H2SO4 dư
Số mol H2 tính theo chất hết => nH2 = 0,2 mol => VH2 = 0,2.22,4 = 4,48 lít
II. TỰ LUẬN (7 điểm)
Câu 1:
a) CH4 + O2 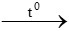 CO2 + 2H2O
CO2 + 2H2O
b) 4P + 5O2 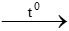 2P2O5
2P2O5
c) CaCO3 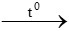 CaO + CO2
CaO + CO2
d) H2 + CuO 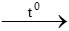 Cu + H2O
Cu + H2O
Câu 2:
- Oxit bazơ: Fe2O3, MgO ,K2O
Fe2O3 : sắt (III) oxit
MgO: magie oxit
K2O : kali oxit
- Oxit axit: CO2, SO3, P2O3, NO2
CO2: cacbon đioxit ( khí cacbonic)
SO3: lưu huỳnh trioxit
P2O3 : điphotpho trioxit
NO2 : nito đioxit
Câu 3:
a) Phương trình hóa học
H2 + CuO 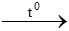 Cu + H2O
Cu + H2O
3H2 + Fe2O3 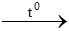 2Fe + 3H2O
2Fe + 3H2O
b) mFe2O3 = 50.80% = 40 gam => nFe2O3 = 40:160 = 0,25 mol
mCuO = 50-40 =10 gam => nCuO= 0,125 mol
H2 + CuO 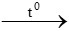 Cu + H2O
Cu + H2O
0,125 mol 0,125 mol
3H2 + Fe2O3 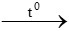 2Fe + 3H2O
2Fe + 3H2O
0,75 mol 0,25 mol
nH2 = 0,125 + 0,75= 0,875 mol
VH2 =0,875. 22,4 = 19,6 lít
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 2)
I. TRẮC NGHIỆM(3 điểm): Hãy chọn đáp án đúng trong mỗi câu sau:
Câu 1: Chất có công thức hóa học nào sau đây là oxit?
A. ZnO
B. Zn(OH)2
C. ZnCO3
D. ZnSO4
Câu 2: Đốt cháy hoàn toàn khí metan (CH4) trong khí oxi (vừa đủ). Sản phẩm của phản ứng là:
A. CO2.
B. H2O.
C. CO2 và H2O.
D. CO2, H2O và O2.
Câu 3: Cho các phương trình hóa học của các phản ứng sau:
Trong các phản ứng trên: số phản ứng hóa hợp, phản ứng phân hủy lần lượt là:
1) CaCO3 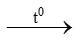 CaO + CO2 3) Zn + 2HCl
CaO + CO2 3) Zn + 2HCl  ZnCl2 + H2
ZnCl2 + H2
2) Fe + S 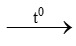 FeS 4) 2Fe + 3Cl2
FeS 4) 2Fe + 3Cl2 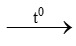 2FeCl3
2FeCl3
Câu 4: Thành phần thể tích của không khí gồm:
A. 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
B. 21% khí nitơ, 78% khí oxi, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
C. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
Câu 5: Đốt cháy hoàn toàn 2,24 lít khí CH4 trong bình chứa khí oxi. Thể tích khí oxi (đo ở đktc) cần dùng là:
A. 2,24 lit B. 3,36 lit C. 4,48 lit D. 6,72 lit
Câu 6: Dãy chất nào sau đây gồm toàn oxit bazơ?
A. SO3; P2O5. B. Na2O; SO3. C. SO2; CaO. D. Na2O; CaO.
II. TỰ LUẬN (7 điểm)
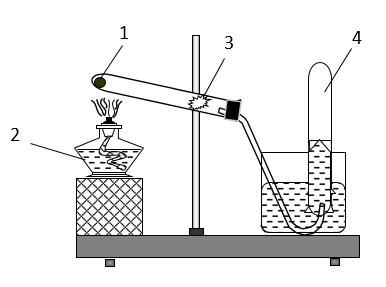
Câu 1 (1 điểm): Cho hình vẽ mô tả thí nghiệm điều chế khí oxi trong phòng thí nghiệm. Hãy xác định 1, 2, 3, 4?
Câu 2 (1 điểm): Giải thích tại sao: Khi nhốt một con dế mèn vào một lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết dù có đủ thức ăn?
Câu 3 (1 điểm): Cho các oxit có công thức hóa học sau: SO2; Fe2O3, CO2, CaO. Chất nào thuộc loại oxit bazơ, chất nào thuộc loại oxit axit. Gọi tên các oxit đó?
Câu 4 (2 điểm): Hoàn thành các phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng nếu có):
a) S + O2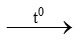 ……… c) KMnO4
……… c) KMnO4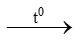 K2MnO4 + MnO2 + …..
K2MnO4 + MnO2 + …..
b) Fe + O2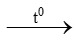 …….. d) ………
…….. d) ………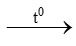 KCl + O2.
KCl + O2.
Câu 5 (2 điểm): Đốt cháy hoàn toàn 2,48 gam photpho trong bình chứa khí oxi, tạo thành điphotpho pentaoxit.
a) Tính khối lượng hợp chất tạo thành?
b) Nếu trong bình chứa 4 gam khí oxi. Hỏi sau khi phản ứng kết thúc chất nào còn dư và dư bao nhiêu gam?
(Cho nguyên tử khối của các nguyên tố: P = 31; O = 16; C =12; H = 1)
------------------ Hết ------------------
HƯỚNG DẪN CHẤM
ĐỀ THI GIỮA HỌC KỲ II – ĐỀ 2
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
A |
C |
B |
A |
C |
D |
Câu 1: Đáp án A
Oxit là hợp chất của 2 nguyên tố, trong đó có 1 nguyên tố là oxi => ZnO
Câu 2: Đáp án C
CH4 + 2O2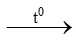 CO2 + 2H2O
CO2 + 2H2O
Do oxi là vừa đủ nên sản phẩm chỉ là CO2, H2O (không còn oxi dư)
Câu 3: Đáp án B
- Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ 2 hay nhiều chất ban đầu. => Phản ứng 2 và 4
- Phản ứng phân hủy là phản ứng hoá học trong đó 1 chất sinh ra hai hay nhiều chất mới
=> phản ứng 1
Câu 4: Đáp án A
Câu 5: Đáp án C
CH4 + 2O2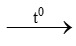 CO2 + 2H2O
CO2 + 2H2O
nCH4 = 2,24 : 22,4 = 0,1 mol
nO2 = 0,1.2 = 0,2 mol
VO2 = 0,2. 22,4 = 4,48 lít
Câu 6: Đáp án D
Oxit bazơ là oxit của kim loại và tương ứng với 1 bazơ.
II. TỰ LUẬN (7 điểm)
Câu 1: (1): KMnO4 hoặc KClO3; (2): đèn cồn; (3): bông; (4): Khí oxi
Câu 2: Vì trong quá trình hô hấp của chúng cần oxi cho quá trình trao đổi chất (quá trình này góp phần vào sự sinh tồn của người và động vật), khi ta đậy nút kín có nghĩa là sau một thời gian trong lọ sẽ hết khí oxi để duy trì sự sống. Do đó con vật sẽ chết.
Câu 3: Oxit bazơ là: Fe2O3 (Sắt (III) oxit), CaO (canxi oxit)
Oxit axit là: SO2 (Lưu huỳnh đioxit), CO2 (cacbon đioxit/ khí cacbonic)
Câu 4:
a) S + O2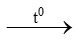 SO2
SO2
b) 3Fe + 2O2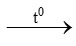 Fe3O4
Fe3O4
c) 2KMnO4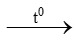 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
d) 2KClO3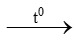 2KCl + 3O2↑
2KCl + 3O2↑
Câu 5:
a) Số mol của P là: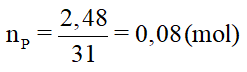
4P + 5O2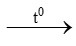 2P2O5 (1)
2P2O5 (1)
Theo PTHH: 4 -------> 2 (mol)
Theo bài ra: 0,08 -------> 0,04 (mol)
Khối lượng P2O5 tạo thành là:
=> 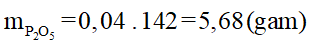
b) Số mol của oxi là: 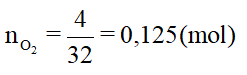
Xét tỉ lệ: 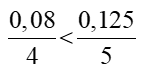 => O2 dư, P phản ứng hết.
=> O2 dư, P phản ứng hết.
4P + 5O2 2P2O5
2P2O5
Theo PTHH: 4 ----> 5 (mol)
Theo bài ra: 0,08 ---> 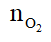
=> Số mol oxi tham gia phản ứng là: 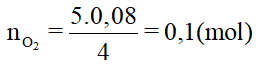
=> Số mol oxi còn dư sau phản ứng: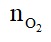 (dư) = 0,125 – 0,1 = 0,025 (mol)
(dư) = 0,125 – 0,1 = 0,025 (mol)
=> Khối lượng oxi còn dư là: m = 0,025 . 32 = 0,8 (g)
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 3)
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1. Để thu khí hiđro trong phòng thí nghiệm bằng cách đẩy nước người ta dựa vào tính chất nào của khí hiđro ?
A. Nhẹ hơn không khí.
C. Không tác dụng với không khí.
B. Không tác dụng với nước.
D. Nhẹ hơn không khí và ít tan trong nước.
Câu 2. Phản ứng thế là phản ứng giữa hợp chất với:
A. H2
B. O2
C. Cu
D. Đơn chất
Câu 3: Hỗn hợp của hiđro nổ mạnh nhất khi tỉ lệ H2: O2 là :
A. 1:1
B. 2:1
C. 3:1
D. 4:1
Câu 4: Cho 13g Zn vào dung dịch chứa 0,5 mol HCl
Thể tích khí H2(đktc) thu được là:
A. 1,12lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Câu 5: Dãy chất nào tác dụng với nước:
A. SO3,CaO,P2O5
C. Al2O3,SO3,CaO
B. Na2O,CuO,P2O5
D. CuO,Al2O3,Na2O
Câu 6: Khí X có tỷ khối với H2 là 8,5. X là khí nào cho dưới đây:
A. SO2
B. NH3
C. O2
D. Cl2
II. TỰ LUẬN (7 điểm)
Câu 1: Trong các oxit sau, oxit nào tác dụng với nước. Nếu có hãy viết phương trình phản ứng : K2O, Al2O3, P2O5, SO3, CaO
Câu 2: Hoàn thành các phương trình phản ứng sau:
a. ZnO +H2 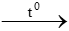 b. KMnO4
b. KMnO4 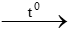 K2MnO4 + MnO2 + …..
K2MnO4 + MnO2 + …..
c. S + O2 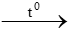 d. Mg + O2
d. Mg + O2 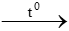
Câu 3: Cho 3,25 g Zn tác dụng với một lượng HCl vừa đủ. Dẫn toàn bộ lượng khí sinh ra cho đi qua 6g CuO đun nóng.
a) Viết phương trình hoá học xảy ra?
b) Tính khối lượng Cu thu được sau phản ứng và cho biết chất nào là chất khử? Chất oxi hoá?
c) Chất nào còn dư sau phản ứng hiđro khử CuO? Khối lượng dư là bao nhiêu?

HƯỚNG DẪN CHẤM
ĐỀ THI GIỮA HỌC KỲ II – ĐỀ 3
MÔN: HÓA HỌC 8
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1: Đáp án B
Câu 2: Đáp án D
Câu 3: Đáp án B
Hỗn hợp khí hi đro và oxi là hỗn hợp nổ, sẽ nổ mạnh nhất nếu trộn H2 và O2 theo tỉ lệ về thể tích đúng như hệ số các chất trong phương trình hóa học
2H2 + O2 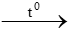 2H2O
2H2O
Câu 4: Đáp án D
nH2 = 13: 65 = 0,2 mol
Zn + 2HCl 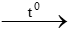 ZnCl2 + H2
ZnCl2 + H2
0,2 0,5 0,2 (mol)
Vì 0,2:1 < 0,5 :2 => Zn hết, HCl dư => H2 tính theo Zn
n H2 = 0,2 mol => VH2 = 0,2.22,4 = 4,48 lít
Câu 5: Đáp án A
SO3 + H2O 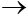 H2SO4
H2SO4
CaO + H2O 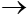 Ca(OH)2
Ca(OH)2
P2O5 + 3H2O 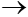 2H3PO4
2H3PO4
Câu 6: Đáp án B
MX = 8,5.2 =17 => X là NH3
II. TỰ LUẬN (7 điểm)
Câu 1: Các oxit tác dụng với nước
K2O + H2O 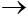 2KOH
2KOH
P2O5 + 3H2O 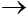 2H3PO4
2H3PO4
SO3 + H2O 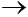 H2SO4
H2SO4
CaO + H2O 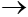 Ca(OH)2
Ca(OH)2
Câu 2:
a. ZnO +H2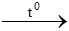 Zn + H2O
Zn + H2O
b. 2KMnO4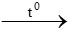 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
c. S + O2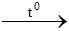 SO2
SO2
d. 2Mg + O2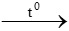 2MgO
2MgO
Câu 3:
a) Viết phương trình hóa học:
Zn + 2HCl 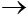 ZnCl2 + H2
ZnCl2 + H2
H2 + CuO 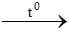 Cu + H2O
Cu + H2O
b) nZn = 3,25 : 65 = 0,05 mol => nH2 = 0,05 mol
nCuO = 6 : 80 = 0,075 mol
Vì 0,05 : 1< 0,075 : 1 => CuO dư, H2 hết nên tính số mol Cu theo H2
H2 + CuO 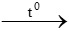 Cu + H2O
Cu + H2O
0,05 mol 0,05 mol
=> nCu = 0,05 mol => mCu = 0,05.64 = 3,2 gam
Trong phản ứng trên H2 chiếm O của CuO => H2 là chất khử
CuO nhường O cho H2=> CuO là chất oxi hóa
c) Trong phản ứng H2 khử CuO, CuO dư
nCuO dư = 0,075 – 0,05 = 0,025 mol
mCuO dư = 0,025.80 = 2 gam
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 4)
I. TRẮC NGHIỆM (3 điểm): Hãy chọn đáp án đúng trong mỗi câu sau:
Câu 1. Trong phòng thí nghiệm, oxi được điều chế từ 2 chất nào sau đây?
A. CuO; Fe3O4
B. KMnO4; KClO3
C. Không khí; H2O
D. KMnO4; MnO2
Câu 2. Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp:
A. S + O2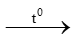 SO2
SO2
B. CaCO3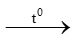 CaO + CO2
CaO + CO2
C. CH4 + 2O2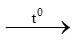 CO2 + 2H2O
CO2 + 2H2O
D. 2H2O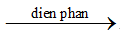 2H2 + O2
2H2 + O2
Câu 3. Trong các phản ứng sau, phản ứng nào xảy ra sự oxi hóa
A. CaO + H2O → Ca(OH)2
B. S + O2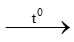 SO2
SO2
C. K2O + H2O → 2KOH
D. CaCO3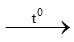 CaO + CO2
CaO + CO2
Câu 4. Người ta thu khí oxi bằng cách đẩy không khí dựa vào tính chất nào sau đây của oxi:
A. Khí O2 nhẹ hơn không khí
C. Khí O2 là khí không mùi.
B. Khí O2 dễ hoà tan trong nước.
D. Khí O2 nặng hơn không khí
Câu 5. Hiện tượng nào sau đây là sự oxi hóa chậm:
A. Đốt cồn trong không khí.
B. Sắt để lâu trong không khí bị gỉ.
C. Nước bốc hơi.
D. Đốt cháy lưu huỳnh trong khôngkhí.
Câu 6. Phản ứng nào dưới đây là phản ứng phân hủy
A. CuO + H2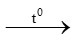 Cu + H2O
Cu + H2O
B. CO2 + Ca(OH)2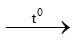 CaCO3 + H2O
CaCO3 + H2O
C. CaO + H2O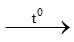 Ca(OH)2
Ca(OH)2
D. Ca(HCO3)2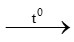 CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O
II. TỰ LUẬN (7 điểm)
Câu 1: Cho các chất sau: SO2, Fe2O3, Al2O3, P2O5. Đọc tên và hãy cho biết những chất nào là oxit bazơ, là oxit axit?
Câu 2: Hoàn thành phản ứng sau:
a) S + O2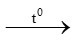
b) Fe + O2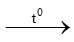
c) P + O2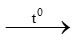
d) CH4 + O2 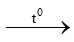
Câu 3: Đốt cháy hoàn toàn 16,8 gam Sắt (Fe) trong không khí
a) Tính khối lượng sản phẩm thu được?
b) Tính thể tích khí oxi, và thể tích không.khí cần dùng ở đktc? (biết rằng oxi chiếm 20% thể tích không khí)
c) Tính khối lượng KMnO4 cần dùng để điều chế đủ oxi cho phản ứng trên? Biết rằng lượng oxi thu được hao hụt 20%
Cho biết: Fe = 56, O = 16, K = 39, Mn = 55
------------------ Hết ------------------
HƯỚNG DẪN CHẤM
ĐỀ THI GIỮA HỌC KỲ II – ĐỀ 2
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
B |
A |
B |
D |
B |
D |
Câu 1: Đáp án B
Trong phòng thí nghiệm, khí oxi đươc điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như KMnO4 và KClO3
Câu 2: Đáp án A
- Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ 2 hay nhiều chất ban đầu. => Phản ứng A
Câu 3: Đáp án B
Sự tác dụng của oxi với 1 chất là sự oxi hóa
Câu 4: Đáp án D
Thu khí oxi bằng hai cách: đẩy không khí hoặc đẩy nước
Oxi đẩy không khí ra khỏi lọ vì oxi nặng hơn không khí.
Câu 5: Đáp án B
Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt nhưng không phát sáng, thường xảy ra trong tự nhiên : các đồ vật bằng gang, thép trong tự nhiên dần biến thành oxit, sự oxi hóa chậm các chất hữu cơ trong cơ thể diễn ra liên tục,…
Câu 6: Đáp án D
Phản ứng phân hủy là phản ứng hoá học trong đó 1 chất sinh ra hai hay nhiều chất mới
II. TỰ LUẬN (7 điểm)
Câu 1:
Oxit axit: SO2, P2O5
SO2: Lưu huỳnh đioxit
P2O5: điphotpho pentaoxit
Oxit bazơ: Fe2O3, Al2O3
Fe2O3: Sắt (III) oxit
Al2O3: Nhôm oxit
Câu 2:
a) S + O2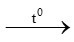 SO2
SO2
b) 3Fe + 2O2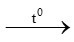 Fe3O4
Fe3O4
c) 4P + 5O2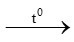 2P2O5
2P2O5
d) CH4 + 2O2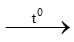 CO2 + 2H2O
CO2 + 2H2O
Câu 3:
a/ Số mol Fe là : nFe = 16,8: 56 = 0,3 mol
PTPƯ:
3Fe + 2O2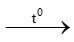 Fe3O4 (1)
Fe3O4 (1)
0,3 mol → 0,2mol → 0,1 mol
Từ (1) ta có số mol Fe3O4 = 0,1mol
→ m Fe3O4 = n.M = 0,1.232 = 23,2gam
b/ Từ (1) ta có số mol O2 đã dùng nO2 = 0,2 mol
Thể tích khí oxi đã dùng ở đktc: VO2 = n.22,4 = 0,2.22,4 = 4,48 lít
Thể tích không khí đã dùng: Vkk = 5. VO2= 5.4,48 = 22,4 lít.
c/ PTPƯ
2 KMnO4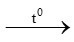 K2MnO4 + MnO2 + O2 (2)
K2MnO4 + MnO2 + O2 (2)
0,4444mol ← 0,222mol
Vì lượng Oxi thu được hao hụt 10% nên số mol O2 cần có là:
nO2 = 0,2mol.100/90 = 0.222 mol
Từ (2) ta có số mol KMnO4 = 0,444mol
Khối lượng KMnO4 bị nhiệt phân
mKMnO4 = n.M = 0,444.158 = 70.152 gam
Bộ 40 Đề thi Hóa học lớp 8 Giữa kì 2 có đáp án năm 2024 - Đề 5
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 5)
I. TRẮC NGHIỆM (3 điểm)
Câu 1. Phát biểu nào sau đây về oxi là không đúng?
A. Oxi là phi kim hoạt động hoá học rất mạnh
B. Oxi tạo oxit bazơ với hầu hết kim loại
C. Oxi không có mùi và vị
D. Oxi cần thiết cho sự sống
Câu 2. Oxit nào sau đây làm chất hút ẩm?
|
A. Fe2O3 |
B. Al2O3 |
C. CuO |
D. CaO |
Câu 3. Dãy oxit nào có tất cả các oxit đều tác dụng được với nước ở nhiệt độ thường
|
A. SO3, CaO, CuO, Al2O3 |
C. MgO, CO2, SiO2, PbO |
|
B. SO3, K2O, BaO, N2O5 |
D. SO2, Al2O3, HgO, Na2O |
Câu 4. P có thể có hoá trị III hoặc V. Hợp chất có công thức P2O5 có tên gọi là:
|
A. Điphotpho oxit |
C. Photpho pentaoxit |
|
B. photpho oxit |
D. Điphotpho pentaoxit |
Câu 5. Có 4 lọ đựng riệng biệt: nước cất, dung dịch H2SO4, dung dịch NaOH, dung dịch NaCl. Bằng cách nào có thể nhận biết được mỗi chất trong các lọ?
|
A. Giấy quì tím |
C. Nhiệt phân và phenolphtalein |
|
B. Giấy quì tím và đun cạn |
D. Dung dịch NaOH |
Câu 6. Axit là những chất làm cho quì tím chuyển sang màu nào trong số các màu cho dưới đây?
|
A. Xanh |
B. Đỏ |
C. Tím |
D. Không xác định |
Câu 7. Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
|
A. Tăng |
B. Giảm |
C.Tăng hoặc giảm |
D. Không thay đổi |
Câu 8. Trong 225 g nước có hoà tan 25g KCl. Nồng độ phần trăm của dung dịch là:
A. 10% B. 11%
C. 12% D. 13%
Câu 9. Hoà tan 16g SO3 vào nước để được 300ml dung dịch. Nồng độ của dung dịch H2SO4 thu được là:
A. 0,67M B. 0,68M
C. 0,69M D, 0,7M
Câu 10. Phản ứng nào dưới đây là phản ứng thế:
A. 2KClO3 2KCl + O2
B. P2O5 +3H2O 2H3PO4
C. FeO + 2HCl FeCl2 + H2O
D. CuO + H2 Cu + H2O
Phần 2. Tự luận (6 điểm )
Câu 1. (2 điểm) Hòan thành các sơ đồ phản ứng sau:
Ca CaO Ca(OH)2 CaCO3 CO2
Câu 2. (1,5 điểm) Cho các chất có công thức hóa sau: H2SO4, Fe2(SO4)3, HClO, Na2HPO4. Hãy gọi tên và phân loại các chất trên.
Câu 3. (2,5 điểm) Người ta dẫn luồng khí H2 đi qua ống đựng 4,8 gam bột CuO được nung nóng trên ngọn lửa đèn cồn, cho đến khi toàn bộ lượng CuO màu đen chuyển thành Cu màu đỏ thì dừng lại.
a) Tính số gam Cu sinh ra?
b) Tính thể tích khí hiđro (đktc) vừa đủ dùng cho phản ứng trên ?
Để có lượng H2 đó phải lấy bao nhiêu gam Fe cho tác dụng vừa đủ với bao nhiêu gam axít HCl.
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (4 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
A |
D |
B |
D |
B |
B |
A |
B |
A |
D |
Câu 8: B
Nồng độ phần trăm dung dịch KCl là:
Câu 9: A
II. TỰ LUẬN (6 ĐIỂM)
Câu 1. (2 điểm)
(1) 2Ca + O2 2CaO
(2) CaO + H2O Ca(OH)2
(3) Ca(OH)2 + CO2 CaCO3 + H2O
(4) CaCO3 CaO + CO2
Câu 2. (1,5 điểm)
H2SO4: axit sunfuric
Fe2(SO4)3: muối sắt (III) sunfat
HClO: axit hipoclorơ
Na2HPO4: muối natri hiđrophotphat
Câu 3(2,5 điểm)
a) CuO + H2 Cu + H2O
Theo phương trình ta có:
Số mol của CuO = Số mol của Cu = 0,06 (mol)
=> Khối lượng của Cu sinh ra là:0,06 x 64= 3,84g
b) Số mol CuO = Số mol H2 = 0,06 (mol)
=> Thể tích của H2 = 0,06 x 22,4 =1,344 lít
c) Fe + 2HCl FeCl2 + H2
Theo phương trình ta có: Số mol Fe = Số mol H2 = 0,06 56 = 3,36 gam
Bộ 40 Đề thi Hóa học lớp 8 Giữa kì 2 có đáp án năm 2024 - Đề 6
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 6)
I. TRẮC NGHIỆM (4 điểm)
Câu 1. Người ta thu khí oxi bằng cách đẩy không khí là dựa vào tính chất
A. Khí oxi nhẹ hơn không khí
B. Khí oxi nặng hơn không khí
C. Khí oxi khó hóa lỏng
D. Khí oxi dễ trộn lẫn với không khí
Câu 2. Để dập tắt đám cháy người ta cần
|
A. Quạt mạnh vào đám cháy |
B. Cách li chất cháy với oxi |
|
C. Duy trì nhiệt độ đám cháy |
D. Cung cấp thêm oxi |
Câu 3. Cặp chất nào dùng để điều chế hidro trong phòng thí nghiệm
|
A. Zn và dung dịch HCl |
B. Cu và dung dịch H2SO4 loãng |
|
C. Cu và dung dịch HCl |
D. Ag và dung dịch HCl |
Câu 4. Dãy chất nào sau đây tan được trong nước:
A. NaCl, AgCl, Ba(OH)2, Na(OH), HCl
B. HNO3, H2SiO3, HCl, H2SO4, NaCl
C. NaOH, Ba(OH)2, KOH, NaCl, HCl
D. CuO, AlPO4, NaOH, KOH, NaCl, HCl
Câu 5. Sản phẩm nào của phản ứng sau làm quỳ hóa xanh
|
A. SO3 + H2O |
B. CuO + H2 |
C. Fe + O2 |
D. Na2O + H2O |
Câu 6. Dãy các chất hoàn toàn là công thức hóa học của các oxit:
A. SO2, BaO, P2O5, ZnO, CuO
B. SO2, BaO, KClO3, P2O5, MgO
C. CaO, H2SO4, P2O5, MgO, CuO
D. SO2, CaO, KClO3, NaOH, SO3
Câu 7. Khử 32g Fe(III) oxit bằng khí Hidro. Khối lượng sắt thu được là
|
A. 22,4 gam |
B. 11,2 gam |
C. 33,6 gam |
D. 5,6 gam |
II. TỰ LUẬN (6 điểm)
Câu 1. (1,5 điểm) Hoàn thành các phương trình hóa học sau, và cho biết phản ứng nào là phản ứng phân hủy, phản ứng nào là phản ứng thế?
a) ……… +……… H3PO4
b) KClO3 ……… + ………
c) ……… + …….. SO2
d) KMnO4 ……… + ……… + ……….
e) Mg + HCl ……… +………
f) Fe + H2SO4 ……… + ………
g) BaO + H2O ……
Câu 2. (1 điểm) Bằng phương pháp hóa học nhận biết 4 bình đựng riêng biệt các khí sau: không khí, khí oxi, khí hiđro, khí cacbonic
Câu 3. (2,5 điểm) Cho 11,2 g sắt vào 200 ml dung dịch H2SO4 2M. Hãy:
a) Tính lượng khí H2 tạo ra ở đktc?
b) Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu?
Câu 4. (1 điểm) Hai nguyên tử M kết hợp với 1 nguyên tử oxi tạo ra phân tử oxit. Trong phân tử, nguyên tố oxi chiếm 25,8% về khối lượng. Tìm nguyên tố M
Cho nguyên tử khối của các nguyên tố: Cu=64; O=16; Cl=35,5; Fe=56; H = 1; Na = 23; S=32
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (4 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
B |
B |
A |
C |
D |
A |
A |
Câu 7:
nFe2O3 = 0,2 mol
Số mol Fe: 2.0,2 =0,4 mol
Khối lượng sắt là: 0,4.56 = 22,4 gam
II. TỰ LUẬN ( 6 điểm)
Câu 1(1,5 điểm)
a) 3H2O + P2O5 2H3PO4
b) 2KClO3 2KCl + 3O2
c) S + O2 SO2
d) 2KMnO4 K2MnO4 + MnO2 + O2
e) Mg + 2HCl MgCl2 + H2
f) Fe + H2SO4 FeSO4 + H2
g) BaO + H2O Ba(OH)2
Phản ứng phân hủy: b), d)
Phản ứng thế: e, f
Câu 2(1 điểm)
Dùng que đóm có tàn đỏ cho lần lượt vào bình đựng các khí
Lọ làm tàn đỏ bùng cháy cho ngọn lửa vàng là O2
Dẫn 3 khí còn lại qua đồng (II) oxit đã nung nóng, nếu lọ nào làm CuO chuyển từ màu đen sang màu đỏ thì lọ đó có chứa khí H2
CuO + H2 → Cu + H2O
Dẫn 2 khí còn lại vào dung dịch nước vôi trong Ca(OH)2 nếu lọ làm nước vôi trong vẩn đục thì lọ đó có chứa khí CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Lọ không làm nước vôi trong vẩn đục còn lại là không khí
Câu 3(2,5 điểm)
a. PTHH: Fe + H2SO4 FeSO4 + H2 (1)
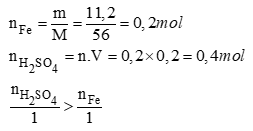
Vậy H2SO4 dư, tính theo Fe
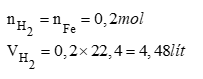
b. Theo phương trình (1)
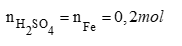
Số mol H2SO4 dư = Số mol H2SO4 ban đầu - Số mol H2SO4 phản ứng
= 0,4 - 0,2 = 0,2 mol
Số gam H2SO4 dư = 0,2 x 98 = 19,6g
Câu 4(1 điểm)
Gọi công thức phân tử cần tìm là M2O
Theo đề bài ta có:
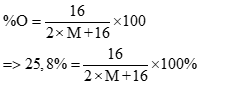
Giải phương trình tìm được M = 23 => Na
Vậy phân tử cần tìm là: Na2O
Bộ 40 Đề thi Hóa học lớp 8 Giữa kì 2 có đáp án năm 2024 - Đề 7
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 7)
I. TRẮC NGHIỆM (3 điểm)
Câu 1. Đốt cháy 6,2 g photpho trong bình chứa 5,6 lít oxi, sau phản có chất nào còn dư?
A. Oxi
B. Photpho
C. Hai chất vừa hết
D. Không xác định được
Câu 2. Oxit phi kim nào dưới đây không phải là oxit axit?
|
A. SO2 |
B. SO3 |
C. NO |
D. N2O5 |
Câu 3. Tại sao trong phòng thí nghiệm người ta lại điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3?
A. Dễ kiếm, giá thành rẻ
B. Giàu oxi và dễ phân huỷ ra oxit
C. Phù hợp với thiết bị máy móc hiện đại
D. Không độc hại, dễ sử dụng
Câu 4. Trong phòng thí nghiệm cần điều chế 2,24 lít O2 (đktc). Dùng chất nào sau đây để cần ít khối lượng nhất:
|
A. KClO3 |
B. KMnO4 |
C. KNO3 |
D. H2O |
Câu 5. Cặp chất nào sau đây khi tan trong nước chúng tác dụng với nhau tạo ra chất khí bay ra?
A. BaCl2 và H2SO4
B. NaCl và Na2SO3
C. HCl và Na2CO3
D. AlCl3 và H2SO4
Câu 6. Hòa tan 7,5 gam muối NaCl vào 50 gam nước ở 20oC thì được dung dịch bão hòa. Độ tan của NaCl ở nhiệt độ đó là:
|
A. 35 gam |
B. 30 gam |
C. 15 gam |
D. 20 gam |
Câu 7. Trong oxit, kim loại có hoá trị III và chiếm 52,94% về khối lượng là:
|
A. Cr2O3 |
B. Al2O3 |
C. As2O3 |
D. Fe2O3 |
Phần 2. Tự luận (7 điểm)
Câu 1. (1,5 điểm) Hoàn thành và cân bằng phương trình phản ứng dưới đây
a) Fe + HCl → ? + ?
b) H2 + Fe3O4 → ? + ?
c) Fe + CuSO4 → ? + ?
d) CaO + H2O → ?
e) SO2 + O2 → ?
Câu 2. (2 điểm) Điền cụm từ thích hợp vào chỗ chấm:
a) Dung dịch ………….. là dung dịch có thể hòa tan thêm………….. ở nhiệt độ xác định. Dung dịch ……………… là dung dịch không thể hòa tan thêm ………… ở nhiệt độ xác định.
b) Ở nhiệt độ xác định, số gam chất có thể tan trong 100g nước để tạo thành …………được gọi là ………… của chất.
c) Yếu tố ảnh hưởng đến độ tan của đa số chất rắn là ……….., độ tan của chất khí trong nước sẽ tăng nếu ta……….. và tăng………………
Câu 3. (2 điểm) Cho 2,7 gam Al tác dụng với HCl dư
a) Viết phương trình hóa học xảy ra.
b) Tính thể tích H2 sinh ra ở đktc.
c) Tính khối lượng muối thu được sau phản ứng.
Câu 4. (1,5 điểm) Cần lấy bao nhiêu ml dung dịch có nồng độ 36% (d=1,19g/ml) để pha 5 lít HCl có nồng độ 0,5M
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (3 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
C |
C |
B |
A |
C |
C |
B |
Câu 1:C
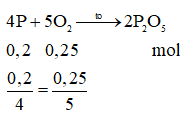
Nên hai chất vừa hết
Câu 6: C
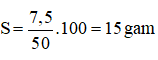
Câu 7: B
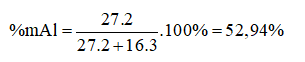
II. TỰ LUẬN (7 điểm)
Câu 1.
a) Fe + 2HCl → FeCl2 + H2
b) 4H2 + Fe3O4 3Fe + 4H2O
c) Fe + CuSO4 → FeSO4 + Cu
d) CaO + H2O → Ca(OH)2
e) 2SO2 + O2 2SO3
Câu 2.
a) Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan ở nhiệt độ xác định. Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan ở nhiệt độ xác định.
b) Ở nhiệt độ xác định, số gam chất tan có thể tan trong 100 gam nước để tạo thành dung dịch bão hòa được gọi là độ tan của chất
c)Yếu tố ảnh hưởng đến độ tan của đa số chất rắn là nhiệt độ, độ tan của chất khí trong nước sẽ tăng nếu giảm nhiệt độ và tăng áp suất.
Câu 3.
a) nAl = 0,1 mol
PTHH:
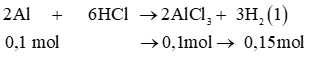
b) Dựa vào phương trình (1) ta có nH2 = 0,1 x 1,5 = 0,15 mol
Thể tích của H2: 0,15 x 22,4 = 3,36 lít
c) Dựa vào phương trình (1) ta có n AlCl3 = 0,1 mol
Khối lượng muối sau phản ứng: 0,1 x 133,5= 13,35 gam
Câu 4.
Khối lượng HCl: 5 x 0,5 x 36,6 = 91,25 gam
Khối lượng dung dịch HCl 36% cần dùng là: (91,25 x 100) : 36 = 253,47 gam
Thể tích dung dịch cần dùng là: 253,46 : 1,19 = 213 ml
Bộ 40 Đề thi Hóa học lớp 8 Giữa kì 2 có đáp án năm 2024 - Đề 8
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 8)
I .TRẮC NGHIỆM (4,0đ) Chọn ý đúng A hoặc B, C, D ghi vào bảng sau :
Câu 1. Chất nào sau đây không phải là oxit bazơ:
A. MgO. B. Mn2O7 .
C. FeO. D. CuO.
Câu 2. Ở nhiệt độ thường, nước tác dụng được với dãy chất:
A. K, Na2O, Fe, ZnO
B. CuO, Zn, K2O, CO2.
C. Ba, Fe2O3, Al, SO2.
D. K, Na, CaO, P2O5.
Câu 3. Dung dịch là hỗn hợp
A. của chất khí trong chất lỏng.
B. của chất rắn trong chất lỏng.
C. đồng nhất của dung môi và chất tan.
D. đồng nhất của chất rắn trong chất lỏng.
Câu 4. Khi nhiệt độ tăng thì độ tan của chất rắn trong nước:
A. Phần lớn là tăng.
B. Phần lớn là giảm.
C. Đều giảm.
D. Đều tăng
Câu 5. Cho các phương trình hóa học sau:
a. H2 + ZnO Zn + H2O
b. S + O2 SO2
c. 2HgO 2Hg + O2
d. Ca(HCO3)2 CaCO3 + CO2 + H2O
Phương trình thuộc loại phản ứng phân hủy:
A. a,b. B. b, c.
C. c, d . D. a, d.
Câu 6. Có 3 dung dịch mất nhãn: HCl, NaCl, NaOH. Dùng thuốc thử nào để nhận biết 3 dung dịch?
A. Fe . B. Cu
C. H2O D. Quỳ tím.
Câu 7. Nguyên liệu điều chế khí oxi trong phòng thí nghiệm :
A. KMnO4, KClO3.
B. KClO3, H2O.
C. KMnO4, Không khí.
D. Nước, Không khí.
Câu 8. Ở 100 C, hòa tan 4g NaCl vào 25g nước. Độ tan của NaCl ở nhiệt độ trên là
A. 13,8g. B. 16g.
C. 21g. D. 25g.
II. TỰ LUẬN (6,0đ)
Câu 1 (1,0đ). Phân loại và đánh dấu X vào ô chỉ hợp chất oxit, axit, bazơ, muối :
|
|
NaOH |
CO2 |
H2SO3 |
Na2SO4 |
|
Oxit |
|
|
|
|
|
Axit |
|
|
|
|
|
Bazơ |
|
|
|
|
|
Muối |
|
|
|
|
Câu 2 (2,0đ). Hoàn thành các phương trình hóa học sau:
a. Cu + ? CuO .
b. KClO3 KCl + ?
c. ? + H2O Ca(OH)2 + ?
d. H2 + Fe3O4 ? + ?
Câu 3 (2,0đ). Cho 7,2g magie vào dung dịch HCl thu được magie clorua (MgCl2) và khí hiđrô.
a. Tính thể tích khí hiđrô sinh ra (đktc).
b. Nếu cho lượng kim loại trên vào 200g dung dịch HCl. Tính nồng độ phần trăm của dung dịch sau phản ứng.( Mg = 24; H = 1; Cl = 35,5 )
Câu 4 (1,0đ). Hòa tan 11,7g Kim loại A (chưa rõ hóa trị) vào nước dư thu được 3,36 lít H2 (đktc). Tìm kim loại A? (Ba = 137, Na = 23, K = 39, Ca = 40)
Đáp án và hướng dẫn giải:
I.TRẮC NGHIỆM: (4,0đ)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
D |
C |
A |
C |
D |
A |
B |
Câu 6: D
Sử dụng thuốc thử là quì tím vì:
- HCl: axit làm quì tím chuyển đỏ
- NaOH : bazo làm quì tím hóa xanh
- NaCl: quì tím không đổi màu
Câu 8: B
Độ tan
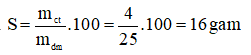
II. TỰ LUẬN (6,0đ)
Câu 1(1 đ)
Oxit: CO2
Axit: H2SO3
Bazơ: NaOH
Muối: Na2SO4
Câu 2: (2 đ)
Lập PTHH:
a. 2Cu + O2 2CuO .
b. 2KClO3 2KCl + 3O2
c. Ca + 2H2O Ca(OH)2 + H2.
d. 4H2 + Fe3O4 3Fe + 4H2O
Câu 3: (2 đ)
a, Số mol của magie:
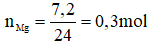
PTHH:
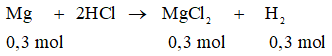
Thể tích khí hiđrô sinh ra (đktc):
= 0,3 . 22,4 = 6,72 (lít)
a. - Khối lượng MgCl2 :
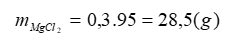
- Khối lượng dung dịch MgCl2 :
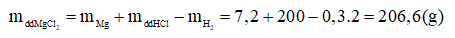
- Nồng độ phần trăm của đung dịch MgCl2:
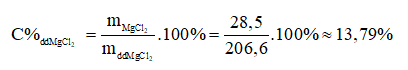
Câu 4:(1đ)
Số mol của H2 :
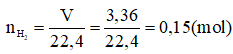
Gọi NTK của kim loại A là A, hóa trị A là n.
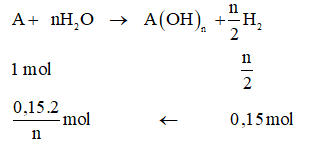
Ta có:
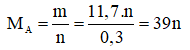
|
n |
1 |
2 |
3 |
|
MA |
39(Nhận) |
78(loại) |
117(loại) |
Chọn n = 1, A = MA = 39 .Vậy A là kali.
Bộ 40 Đề thi Hóa học lớp 8 Giữa kì 2 có đáp án năm 2024 - Đề 9
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 9)
I. TRẮC NGHIỆM (5 điểm)
Câu 1. Thành phần của không khí (theo thể tích):
A. 21% O2, 78% N2 và 1 % là hơi nước.
B. 21% O2, 78% N2 và 1 % là các khí khác.
C. 21% O2, 78% N2 và 1 % là khí CO2.
D. 20% O2, 80% N2.
Câu 2. Nhóm các chất nào sau đây đều là axit?
A. HCl, H3PO4, H2SO4, H2O.
B. HNO3, H2S, KNO3, CaCO3, HCl.
C. H2SO4, H3PO4, HCl, HNO3.
D. HCl, H2SO4, H2S, KNO3.
Câu 3. Cho dãy chất sau: CO2, P2O5, CaCO3, SO3, Na2O, SiO2, CO, ZnO, PbO, N2O5, NO. Những chất nào là oxit axit?
A. CO2, CaCO3, SO3, Na2O, SiO2.
B. CO2, ZnO, P2O5, SO3, SiO2,NO.
C. CO2, , SO3, , CO, N2O5, PbO .
D. CO2, SO3, SiO2, N2O5, P2O5.
Câu 4. Phản ứng hóa học nào dưới đây không phải là phản ứng thế?
A. CuO + H2 Cu + H2O
B. MgO + 2HCl MgCl2+ H2
C. Ca(OH)2 + CO2 CaCO3 + H2O
D. Zn + CuSO4 Cu + ZnSO4
Câu 5. Tính số gam nước tạo ra khi đốt cháy hoàn toàn 4,48 lít khí hidro (đktc) trong oxi?
A. 3,6 g
B. 7,2g
C. 1,8 g
D. 14,4g
Câu 6. Càng lên cao, tỉ lệ thể tích khí oxi càng giảm vì:
A. càng lên cao không khí càng loãng .
B. oxi là chất khí không màu không mùi.
C. oxi nặng hơn không khí.
D. oxi cần thiết cho sự sống.
Câu 7. Đốt cháy 6,2g photpho trong bình chứa 10g oxi. Sau phản ứng chất nào còn dư, vì sao?
A. Oxi vì 6,2g photpho phản ứng đủ với 4g oxi.
B. Oxi vì 6,2g photpho phản ứng đủ với 2g oxi.
C. Hai chất vừa hết vì 6,2g photpho phản ứng vừa đủ với 10g oxi.
D. Oxi vì ta thấy tỉ lệ số mol giữa đề bài và phương trình của oxi lớn hơn của P.
Câu 8. Bằng phương pháp hóa học nhận biết các chất sau: NaCl, axit H2SO4, KOH, Ca(OH)2, bằng cách nào?
A. Quỳ tím, điện phân.
B. Quỳ tím
C. Quỳ tím, sục khí CO2
D. Nước, sục khí CO2
Câu 9. Tính khối lượng NaOH có trong 200g dung dịch NaOH 15%.
|
A. 60 gam |
B. 30 gam |
C. 40 gam |
D. 50 gam |
Câu 10. Tính thể tích của dung dịch NaOH 5M để trong đó có hòa tan 60g NaOH.
A. 300 ml C. 150 ml
B. 600 ml D. 750 ml
II. TỰ LUẬN (5 điểm)
Câu 1. (2,5 điểm)
Cho 5,4 gam Al tác dụng với dung dịch HCl phản ứng xảy ra hoàn toàn. Dẫn toàn bộ lượng khí thu được qua CuO nung nóng.
a. Viết phương trình hóa học của phản ứng xảy ra. Tính khối lượng muối thu được sau phản ứng.
b. Tính khối lượng Cu thu được sau phản ứng?
Câu 2. (2,5 điểm)
Cho 6,5 gam Zn phản ứng vừa đủ với 100 ml dung dịch axit HCl.
a. Tính thể tích khí hidro thu được ở điều kiện tiêu chuẩn?
b. Tính nồng độ mol của dung dịch muối thu được sau phản ứng?
(Al = 27, Cu= 64, O = 16, H = 1, Cl = 35,5, Zn = 65, Na = 23, P = 31)
Đáp án và hướng dẫn giải:
I.TRẮC NGHIỆM: (4,0đ)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
D |
C |
A |
C |
D |
A |
B |
Câu 6: D
Sử dụng thuốc thử là quì tím vì:
- HCl: axit làm quì tím chuyển đỏ
- NaOH : bazo làm quì tím hóa xanh
- NaCl: quì tím không đổi màu
Câu 8: B
Độ tan
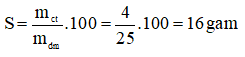
II. TỰ LUẬN (6,0đ)
Câu 1(1 đ)
Oxit: CO2
Axit: H2SO3
Bazơ: NaOH
Muối: Na2SO4
Câu 2: (2 đ)
Lập PTHH:
a. 2Cu + O2 2CuO .
b. 2KClO3 2KCl + 3O2
c. Ca + 2H2O Ca(OH)2 + H2.
d. 4H2 + Fe3O4 3Fe + 4H2O
Câu 3: (2 đ)
b. Số mol của magie:
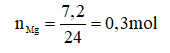
PTHH:
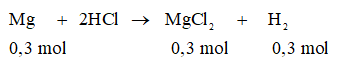
Thể tích khí hiđrô sinh ra (đktc):
= 0,3 . 22,4 = 6,72 (lít)
c. - Khối lượng MgCl2 :
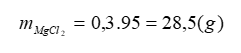
- Khối lượng dung dịch MgCl2 :
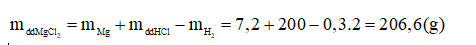
- Nồng độ phần trăm của đung dịch MgCl2:
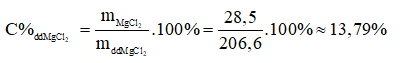
Câu 4:(1đ)
Số mol của H2 :
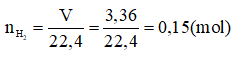
Gọi NTK của kim loại A là A, hóa trị A là n.
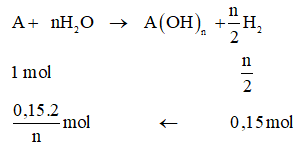
Ta có:
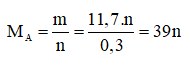
|
n |
1 |
2 |
3 |
|
MA |
39(Nhận) |
78(loại) |
117(loại) |
Chọn n = 1, A = MA = 39 .Vậy A là kali.
Bộ 40 Đề thi Hóa học lớp 8 Giữa kì 2 có đáp án năm 2024 - Đề 10
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 10)
I. TRẮC NGHIỆM (5 điểm)
Câu 1. Ghép một trong các chữ A hoặc B, C, D ở cột I với một chữ số 1 hoặc 2, 3, 4, 5, ở cột II để có nội dung phù hợp.
|
|
Cột I |
|
Cột II |
|
A |
CuO + H2 |
1 |
dung dịch có thể hòa tan thêm chất tan |
|
B |
Phản ứng thế là phản ứng hóa học trong đó |
2 |
Cu + H2O |
|
C |
Thành phần phần trăm theo thể tích của không khí là: |
3 |
dung dịch không thể hòa tan thêm được chất tan nữa. |
|
D |
Dung dịch bão hòa là |
4 |
nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất |
|
E |
Dung dịch chưa bão hòa là |
5 |
78% nitơ, 21% oxi, 1% các khí khác Khí cacbonnic, hơi nước, khí hiếm...) |
|
A-... |
B- ... |
C- ... |
|
D- ... |
E- ... |
Câu 2. Cho các chất sau: C, CO, CO2, S, SO2, SO3, FeO, Fe2O3, Fe, NaOH, MgCO3, HNO3. Dãy chất gồm các oxit?
A. CO, CO2, SO2, FeO, NaOH, HNO3.
B. CO2, S, SO2, SO3, Fe2O3, MgCO3.
C. CO2, SO2, SO3, FeO, Fe2O3, CO.
D. CO2, SO3, FeO, Fe2O3, NaOH, MgCO3.
Câu 3. Cho các phản ứng hóa học sau:
CaCO3 CaO + CO2 (1)
2KClO3 2KCl + 3O2 (2)
2KMnO4 K2MnO4 + MnO2 + O2 (3)
Zn + CuSO4 Cu + ZnSO4 (4)
2H2O 2H2 + O2 (5)
Phản ứng phân hủy là:
|
A. 2; 3; 5; 4 |
C. 4; 1; 5; 3 |
|
B. 1; 2; 3; 5 |
D. 5; 1; 4; 3 |
Câu 4. Sau phản ứng với Zn và HCl trong phòng thí nghiệm, đưa que đóm đang cháy vào ống dẫn khí, khí thoát ra cháy được trong không khí với ngọn lửa màu gì?
|
A. Xanh nhạt. |
B. Cam. |
C. Đỏ cam. |
D. Tím. |
Câu 5. Tính khối lượng Kali penmanganat (KMnO4) cần lấy để điều chế được 3,36 lít khí oxi (đktc).
|
A. 71,1 g |
B. 23,7 g |
C. 47,4 g |
D. 11,85 g |
Câu 6. Có 3 oxit sau: MgO, Na2O, SO3. Có thể nhận biết được các chất đó bằng thuốc thử sau đây không:
A. Dùng nước và giấy quỳ tím.
B. Chỉ dùng nước
C. Chỉ dùng axit
D. Chỉ dùng dung dịch kiềm
Câu 7. Cho 13 gam kẽm tác dụng với 0,3 mol HCl. Sau phản ứng chất nào còn dư và dư bao nhiêu gam?
A. Zn dư ; 6,5 gam.
B. HCl dư; 1,825 gam
C. HCl dư; 3,65 gam
D. Zn dư; 3,25 gam
Câu 8. Trong phòng thí nghiệm khí hidro được điều chế từ chất nào?
A. Điện phân nước
B. Từ thiên nhiên khí dầu mỏ
C. Cho Zn tác dụng với axit loãng (HCl, H2SO4,…)
D. Nhiệt phân KMnO4
Câu 9. Tên gọi của P2O5
A. Điphotpho trioxit
B. Điphotpho pentaoxit
C. Điphotpho oxit
D. Photpho trioxit
Câu 10. Ở 20oC, 60 gam KNO3 tan trong 190 gam nước thì thu được dung dịch bão hòa. Tính độ tan của KNO3 ở tại nhiệt độ đó?
A. 32,58 g
B. 31,55 g
C. 3,17 g
D. 31,58 g
II: TỰ LUẬN (5 điểm)
Câu 1. (2,5 điểm)
|
(1) C2H4 + O2 ……………………. (2)…………………AlCl3 (3)……………………… CuO |
(4) H2O …………………….. (5).………………….. H3PO4 (6) Fe + H2SO4 ……………….. |
Câu 2. (2,5 điểm)
Hòa tan hoàn toàn 19,5 gam Zn phản ứng vừa đủ với 150 dung dịch axit H2SO4. Dẫn toàn bộ khí hidro vừa thoát ra vào sắt (III) oxit dư, thu được m gam sắt.
a. Viết phương trình hóa học xảy ra?
b. Tính nồng độ phần trăm của dung dịch axit H2SO4 đã dùng?
c. Tính m.
(Al = 27, Cu = 64, O = 16, H = 1, Cl = 35,5, Zn = 65, Na = 23, N = 14, S = 32)
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (5 điểm)
Câu 1: 1,5 điểm
|
A-2 |
B- 4 |
C- 5 |
|
D- 3 |
E- 1 |
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C |
B |
A |
C |
A |
D |
C |
B |
D |
Câu 4: A
Khí thoát ra là H2 khi đốt cho ngọn lửa xanh nhạt
Câu 5. C
2KMnO4 K2MnO4 + MnO2 + O2
n O2=0,15 mol nên n KMnO4 =0,3 mol
m KMnO4= 0,3.158= 47,4 gam
Câu 6. A
- Dùng nước:
+ Chất rắn không tan tỏng nước: MgO
+ Chất rắn tan trong nước là Na2O, SO3
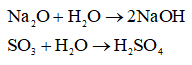
- Dùng quì tím:
+ dung dịch hóa xanh quì là NaOH nên chất đầu là Na2O
+ dung dịch làm quì hóa đỏ là H2SO4 nên chất đầu là SO3
Câu 7: D
n Zn = 0,2 mol
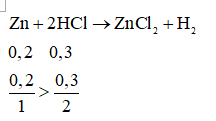
Vậy Zn dư , HCl hết
nZn phản ứng là: 0,15 mol nên nZn dư=0,05 mol
Hay mZn dư= 3,25 gam
Câu 10:D
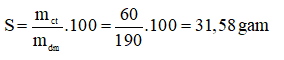
II. TỰ LUẬN (5 điểm)
Câu 1 (2,5 điểm)
(1) C2H4 + 3O2 2CO2 + 2H2O
(2) 2Al + 3Cl2 2AlCl3
(3) 2Cu + O2 2CuO
(4) 2H2O 2H2 + O2
(5) P2O5 + 3H2O 2H3PO4
(6) Fe + H2SO4 FeSO4 + H2
Câu 2. (2,5 điểm)
a) n = 0,3 mol
Zn + H2SO4 ZnSO4 + H2
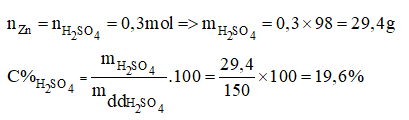
b)
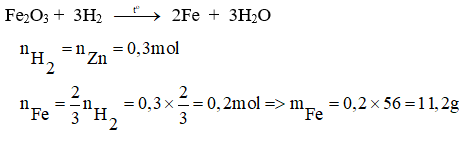
Bộ 40 Đề thi Hóa học lớp 8 Giữa kì 2 có đáp án năm 2024 - Đề 11
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 11)
I. TRẮC NGHIỆM (4 điểm)
Câu 1. Trong các phản ứng hóa học sau, phương trình hóa học thuộc loại phản ứng thế là:
A. CaO + H2O → Ca(OH)2
B. Fe + H2SO4 → FeSO4 + H2
C. CaCO3 CaO + CO2
D. 5O2 + 4P 2P2O5
Câu 2. Độ tan của chất khí trong nước sẽ tăng nếu:
|
A. Giảm nhiệt độ và giảm áp suất |
B. Giảm nhiệt độ và tăng áp suất |
|
C. Tăng nhiệt độ và giảm áp suất |
D. Tăng nhiệt độ và tăng áp suất |
Câu 3. Chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm:
|
A. K2O và KMnO4 |
C. H2SO4 và H2O |
|
B. KMnO4 và KClO3 |
D. KOH và KClO3 |
Câu 4. Các chất nào sau đây tan được trong nước:
|
A. NaCl, AgCl. |
C. NaOH, Ba(OH)2. |
|
B. HNO3, H2SiO3. |
D. CuO, AlPO4. |
Câu 5. Hòa tan 5 g muối ăn vào 45 gam nước. Nồng độ phần trăm của dung dịch thu được là:
|
A. 5% |
B. 10% |
C. 15% |
D. 20% |
Câu 6. Dãy các chất hoàn toàn là công thức hóa học của các oxit:
A. SO2, BaO, P2O5, ZnO, CuO
B. SO2, BaO, KClO3, P2O5, MgO
C. CaO, H2SO4, P2O5, MgO, CuO
D. SO2, CaO, KClO3, NaOH, SO3
Câu 7. Khí hidro tác dụng được với tất cả các chất của nhóm chất nào dưới đây?
A. CuO, FeO, O3
B. CuO, FeO, H2
C. CuO, Fe2O3, H2SO4
D. CuO, CO, HCl
II. TỰ LUẬN (6 điểm)
Câu 1. (1,5 điểm) Hoàn thành các phương trình hóa học sau:
a. K2O + H2O →
b. Na + H2O →
c. Cu + O2 →
d. CxHy + O2 →
Câu 2. (1 điểm) Hãy dự đoán hiện tượng xảy ra và giải thích hiện tượng trong mỗi trường hợp sau:
a) Khi quạt gió vào bếp củi vừa mới tắt
b) Khi quạt gió vào ngọn nến đang cháy
Câu 3. ( 2,5 điểm) Đốt cháy hoàn toàn 6,9 gam Natri thì cần V lít khí oxi đo ở (đktc).
a) Viết phương trình hóa học của phản ứng xảy ra
b) Tính thể tích của khí Oxi đã dùng
c) Toàn bộ sản phẩm đem hòa tan hết trong nước thì thu được 180g dung dịch A. Tính nồng độ phần trăm của dung dịch A.
Câu 4. (1 điểm) Cho 24 gam hỗn hợp oxit CuO và Fe2O3 tác dụng hoàn toàn với hidro có dư thu được 17,6 gam hỗn hợp hai kim loại. Tìm khối lượng nước tao thành.
Cho nguyên tử khối của các nguyên tố: Cu=64, O=16, Cl=35,5, Fe=56, H = 1, Na = 23
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (4 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
B |
C |
B |
C |
B |
A |
A |
Câu 5. B
II. TỰ LUẬN ( 6 điểm)
Câu 1.(1,5 điểm)
a. K2O + H2O → 2KOH
b. 2Na + 2H2O →2 NaOH + H2
c. 2Cu + O2 2CuO
d. CxHy + (x- ) O2 xCO2 + H2O
Câu 2.(1 điểm)
a) Lửa sẽ bùng cháy, do khi quạt gió vào bếp củi thì lượng oxi tăng lên.
b) Nến sẽ tắt do khi quạt gió vào ngọn nến đang cháy sẽ làm nhiệt độ hạ thấp đột ngột
Câu 3(2,5 điểm)
a) PTHH: 4Na + O2 2Na2O (1)
b)
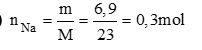
Theo phương trình (1)
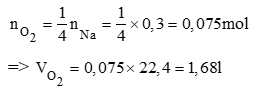
c)PTHH: Na2O + H2O → 2NaOH (2)
Theo phương trình (1)
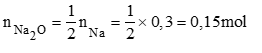
Theo phương trình (2)
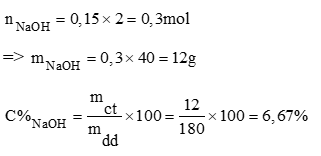
Câu 4:(1 điểm)
Đặt số mol H2O tạo thành là x mol
Ta có số mol H2 phản ứng = số mol H2O = x mol
Áp dụng ĐLBT:
24 + 2x = 17,6 + 18x
x = 0,4 mol
Khối lượng nước là: 0,4 x 18 = 7,2 gam
Đề thi học kì 2 Hóa học lớp 8 có đáp án năm 2024 (15 đề) - Đề 12
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 12)
I. TRẮC NGHIỆM (4 điểm)
Câu 1. Trong các phản ứng hóa học sau, phương trình hóa học thuộc loại phản ứng phân hủy là:
A. CaO + H2O → Ca(OH)2
B. Fe + H2SO4 → FeSO4 + H2
C. CaCO3 CaO + CO2
D. 5O2 + 4P 2P2O5
Câu 2. Sự oxi hóa chậm là:
A. Sự oxi hóa mà không tỏa nhiệt.
B. Sự oxi hóa mà không phát sáng.
C. Sự oxi hóa toả nhiệt mà không phát sáng.
D. Sự tự bốc cháy.
Câu 3. Cho một thìa nhỏ đường vào cốc nước khuấy nhẹ thì
|
A. Đường là dung môi |
C. Nước là chất tan |
|
B. Đường là chất tan |
D. Nước là dung dịch |
Câu 4. Các chất nào sau đây đều gồm các bazơ tan được trong nước:
A. Fe(OH)3, Mg(OH)2, Al(OH)3, KOH
B. Al(OH)3, Mg(OH)2, Zn(OH)3, AgOH
C. Al(OH)3, Ca(OH)2, Fe(OH)3, NaOH
D. Ca(OH)2, Ba(OH)2, NaOH, KOH
Câu 5. Ở nhiệt độ 25oC, khi hòa tan 18 gam NaCl vào cốc chứa 50gam nước thì thu được được dung dịch bão hòa. Độ tan của muối ăn ở nhiệt độ trên là:
|
A. 36 gam |
B. 18 gam |
C. 50 gam |
D. 100 gam |
Câu 6. Dãy các chất hoàn toàn là công thức hóa học của các oxit bazơ:
A. SO2, BaO, P2O5, ZnO, CuO
B. SO2, BaO, ClO3, P2O5, MgO
C. CaO, SO3, P2O5, MgO, CuO
D. MgO, CaO, K2O, ZnO, FeO
Câu 7. Cho các khí: CO, N2, O2, Cl2, H2. Các khí nhẹ hơn không khí là:
A. N2 , H2 , CO B. N2, O2, Cl2 C. CO, Cl2 D. Cl2, O2
II. TỰ LUẬN (6 điểm)
Câu 1. (1,5 điểm) Hoàn thành các phương trình hóa học sau:
a. KMnO4 ……… + ……… + ……….
b. Zn + HCl ……… +………
c. Al2O3 + H2SO4 ……… + ………
d. H2 + ……… Fe + ………
e. CaO + H2O ……
Câu 2. (1 điểm) Hãy dự đoán hiện tượng xảy ra và giải thích hiện tượng trong mỗi trường hợp sau:
a)Khi leo núi hoặc lên cao người ta thường thấy khó thở và tức ngực.
b)Vì sao sự cháy trong không khí lại diễn ra chậm hơn sự cháy trong khí oxi.
Câu 3. (2,5 điểm) Cho a(g) Fe tác dụng vừa đủ 150ml dung dịch HCl (D=1,2g/ml) thu được dung dịch và 6,72 lít khí (đktc). Cho toàn bộ lượng dung dịch trên tác dụng với dung dịch AgNO3 dư, thu được b(g) kết tủa.
a) Viết các phương trình phản ứng hóa học xảy ra?
b) Tìm giá trị a(g), b(g) trong bài?
c) Tính nồng độ phần trăm và nồng độ mol/l dung dịch HCl
Cho nguyên tử khối của các nguyên tố: O = 16; Cl = 35,5; Fe = 56, H = 1; Na = 23; Ag = 108, C = 12
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (4 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
C |
C |
B |
D |
A |
D |
A |
Câu 5: A
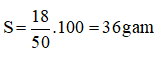
II. TỰ LUẬN ( 6 điểm)
Câu 1(1,5 điểm)
a. 2KMnO4 K2MnO4 + MnO2 + O2
b. Zn + 2HCl ZnCl2 + H2
c. Al2O3 + 3H2SO4 Al2(SO4)3 + 3H2O
d. 3H2 + Fe2O3 2Fe + 3H2O
e. CaO + H2O Ca(OH)2
Câu 2(1 điểm)
a) Càng lên cao không khí càng loãng, thiếu oxi nên cảm thấy khó thở.
b) Trong không khí thể tích khí nito gấp 4 lần thể tích khí oxi nên lượng oxi ít hơn, diện tích tiếp xúc của chất cháy với oxi ít hơn nên sự cháy diễn ra chậm hơn.
Câu 3(2,5 điểm)
a) PTHH: Fe + 2HCl → FeCl2 + H2 (1)
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl (2)
b)

Đề thi học kì 2 Hóa học lớp 8 có đáp án năm 2024 (15 đề) - Đề 13
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 13)
I. TRẮC NGHIỆM (4 điểm)
Câu 1. Trong các phản ứng hóa học sau, phương trình hóa học thuộc loại phản ứng phân hủy là:
A. BaO + H2O → Ba(OH)2
B. Zn + H2SO4 → ZnSO4 + H2
C. 2KMnO2 K2MnO4 + O2 + MnO2
D. 5O2 + 4P 2P2O5
Câu 2. Độ tan của chất rắn trong nước sẽ tăng nếu:
A. Tăng nhiệt độ
B. Giảm nhiệt độ
C. Tăng lượng nước
D. Tăng lượng chất rắn
Câu 3. Chất nào sau đây được dùng để điều chế H2 trong phòng thí nghiệm:
|
A. H2O |
C. Zn và HCl |
|
B. Cu và HCl |
D. Na và H2O |
Câu 4. Dãy muối nào dưới đây tan được trong nước:
A. NaCl, AgCl, Ba(NO3)2
B. AgNO3, BaSO4, CaCO3
C. NaNO3, PbCl2, BaCO3
D. NaHCO3. Ba(NO3)2, ZnSO4
Câu 5. Hòa tan 15gam đường vào 45 gam nước. Nồng độ phần trăm của dung dịch thu được là:
|
A. 25% |
B. 30% |
C. 45% |
D. 40% |
Câu 6. Hòa tan 7,18 gam muối NaCl vào 20gam nước ở 20oC thì được dung dịch bão hòa. Độ tan của NaCl ở nhiệt độ đó là:
|
A. 35 gam |
B. 35,9 gam |
C. 53,85 gam |
D. 71,8 gam |
Câu 7. Trong phòng thí nghiệm người ta dùng phương pháp thu khí oxi bằng phương pháp đẩy nước, dựa vào tính chất nào?
A. Oxi khi tan nhiều trong nước
B. Oxi ít tan trong nước
C. Oxi khó hóa lỏng
D. Oxi nặng hơn không khí
II. TỰ LUẬN (6 điểm)
Câu 1. (1,5 điểm) Hoàn thành và cân bằng phương trình phản ứng dưới đây
f) Mg + HCl → ? + ?
g) MgO + HCl → ? + ?
h) Al + H2SO4 → ? + ?
i) CaO + H3PO4 → ? + ?
j) CaO + HNO3→ ? + ?
Câu 2. (2 điểm) Có 4 lọ mất nhãn đựng riêng biệt: nước cất, dung dịch axit HCl, dung dịch KOH, dung dịch KCl. Nêu cách nhận biết các chất trên?
Câu 3. (2,5 điểm) Hòa tan 6 gam magie oxit vào 50 ml dung dịch H2SO4 (d=1,2g/ml) thì vừa đủ.
a) Viết phương trình phản ứng hóa học xảy ra?
b) Tính khối lượng H2SO4 tham gia phản ứng.
c) Tính nồng độ % của dung dịch H2SO4.
d) Tính nồng độ % của dung dịch muối sau phản ứng.
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (4 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
C |
A |
C |
D |
A |
B |
B |
Câu 5: A
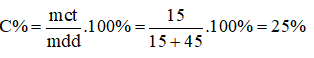
Câu 6:B
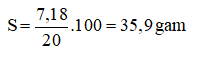
II. TỰ LUẬN (6 điểm)
Câu 1(1,5 điểm)
a) Mg + 2HCl → MgCl2 + H2
b) MgO + 2HCl → MgCl2 + H2O
c) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
d) 3CaO + 2H3PO4 → Ca3(PO4)2+ 3H2O
e) CaO + 2HNO3 → Ca(NO3)2 + H2O
Câu 2(2 điểm)
Trích mẫu thử và đánh số thứ tự.
- Dùng quỳ tím, quỳ chuyển sang màu đỏ là ống nghiệm chứa dung dịch axit HCl, quỳ chuyển sang xanh là ống nghiệm chứa dung dịch KOH.
- Cho 2 dung dịch không làm quỳ chuyển màu đun cạn, dung dịch còn lại cặn là muối KCl, còn lại là nước cất.
Câu 3(2,5 điểm)
a) nMgO = 0,15 mol
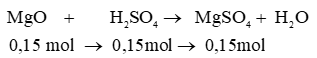
b) Khối lượng của H2SO4: 0,15 x 98 = 14,7 gam
c) Khối lượng dung dịch H2SO4: 50 x 1,2 = 60 gam
Nồng độ C% cuả dung dịch H2SO4:
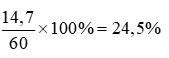
Khối lượng dung dịch sau phản ứng: 60 + 6 = 66 gam
d) Khối lượng MgSO4 : 0,15 x 120 = 18 gam
Nồng độ C% của dung dịch MgSO4:
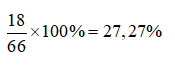
Đề thi học kì 2 Hóa học lớp 8 có đáp án năm 2024 (15 đề) - Đề 14
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2024 - 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: 45 phút
(Đề thi số 14)
Phần 1. Trắc nghiệm (3 điểm)
Câu 1. Tất cả các kim loại trong dãy dưới đây tác dụng được với H2O ở nhiệt độ thường:
|
A. Fe, Zn, Li, S |
B. Cu, Pb, Rb, Ag |
|
C. Al, Hg, Sr, Cu |
D. K, Na, Ba, Ca |
Câu 2. Oxit kim loại nào dưới đây không phải là oxit bazơ?
|
A. CaO |
B. FeO |
C. CuO |
D. CrO3 |
Câu 3. Phản ứng nào dưới đây là phản ứng thế
A. 2KClO3 2KCl + 3O2
B. 6HCl + Fe2O3 → 2FeCl3 + 3H2O
C. 4H2 + Fe3O4 3Fe +4H2O
D. CaO + H2O → Ca(OH)2
Câu 4. Cho 6,5 gam kẽm tác dụng với dung dịch có chứa 10,95 gam HCl. Thể tích khí H2 (đktc) thu được là:
|
A. 1,12 lít |
B. 2,24 lit |
C. 3,36 lít |
D. 6,72 lít |
Câu 5. Xét các phát biểu sau:
1) Hidro ở điều kiện thường tồn tại ở thể lỏng.
2) Hidro nhẹ hơn không khí 0,1 lần
3) Hidro là chất khí không màu không mùi không vị
4) Hidro tan rất ít trong nước
Số phát biểu đúng là:
|
A. 1 |
B. 2 |
C. 3 |
D. 4 |
Câu 6. 1000ml nước ở 15oC hòa tan được bao nhiêu lít khí H2
|
A. 20 |
B. 0,2 |
C. 0,02 |
D. 0,002 |
Câu 7. Trộn 2 lít dung dịch H2SO4 4M vào 4 lít dung dịch H2SO4 0,25M. Nồng độ mol của dung dịch mới là
|
A. 1,5M |
B. 2,5M |
C. 2M |
D. 3,5M |
Câu 8. Khí oxi phản ứng được với tất cả các chất nào trong nhóm sau đây:
|
A. CuO, HgO, H2O |
A. CuO, HgO, H2SO4 |
|
B. CH4, Fe, H2 |
C. CuO, HgO, HCl |
Câu 9. Có 3 lọ mất nhãn đựng các khí O2, CO2, H2. Dùng thuốc thử nào sau đây để nhận biết được 3 lọ trên dễ dàng nhất?
|
A. Que đóm |
B. Que đóm đang cháy |
|
C. Nước vôi trong |
D. Đồng (II) oxit |
Câu 10. Trong phòng thí nghiệm với cùng khối lượng ban đầu thì chất nào sau đây thu được nhiều khí Oxi nhất?
|
A. KMnO4 |
B. KClO3 |
C. H2O |
D. KNO3 |
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Hoàn thành chuỗi phản ứng sau:
KMnO4 → O2 → Fe3O4 → Fe → H2 → H2O
Câu 2. (2 điểm) Cho 8,1 gam kim loại M tác dụng với dung dịch HCl dư thu được 10,08 lít H2 ở điều kiện tiêu chuẩn. Xác định kim loại M biết M hóa trị III.
Câu 3. (3 điểm) Hòa tan hoàn toàn 4 gam kim loại canxi vào nước dư thu được dung dịch chứa m gam bazo tương ứng và V lít khí H2 ở điều kiện tiêu chuẩn.
a) Viết phương trình phản ứng hóa học xảy ra?
b) Tính m và V
c) Dẫn toàn bộ lượng khí H2 thu được ở trên qua ống nghiệm chứa lượng vừa đủ bột CuO nung nóng. Sau khi phản ứng xảy ra hoàn toàn, tính khối lượng kim loại thu được
Đáp án và hướng dẫn giải:
I. TRẮC NGHIỆM (3 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
D |
C |
B |
B |
C |
A |
B |
B |
B |
Câu 4: B
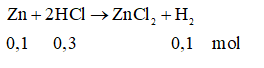
VH2= 0,1. 22,4=2,24 lít
Câu 7: A
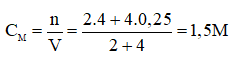
II. TỰ LUẬN (7 điểm)
Câu 1:
1) 2KMnO4 K2MnO4 + O2 + MnO2
2) 2O2 + 3Fe Fe3O4
3) 4H2 + Fe3O4 3Fe +4H2O
4) Fe + 2HCl → FeCl2 + H2
5) 2H2 + O2 2H2O
Câu 2:
Số mol của H2 là:
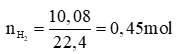
PTHH:
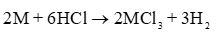
nM = 0,45 . = 0,3 mol
Khối lượng mol của M = 8,1 : 0,3 = 27 => Kim loại M là Al
Câu 3:
a) nCa = 0,1 mol
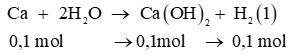
b) Dựa vào phương trình (1) ta có n H2 = 0,1 x 1 = 0,1 mol
Thể tích của H2: 0,1 x 22,4 = 2,24 lít
Số mol bazo Ca(OH)2 = n Ca = 0,1 mol
=> mbazo = 0,1 . (40 + 16.2 + 2) = 7,4 gam
c) H2 + CuO Cu + H2O (2)
Dựa vào phương trình (2) ta có
Số mol của H2 = nCu = 0,1 mol => mCu = 0,1 . 64 = 6,4 gam