Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết, bài tập về hóa học 9 có đáp án, chọn lọc và chi tiết môn Hóa học lớp 9, tài liệu bao gồm 16 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Tuyển tập 100 đề thi học sinh giỏi Hóa 9 (phần 4)
Phần:các phương pháp hoá học và các ví dụ minh hoạ
Bảng một số nguyên tố hóa học thường gặp đối với học sinh lớp 8
STT Tên Việt Nam Tên Latinh KHHH NTK % trong vỏ Trái đất
1 Oxi Oxygenium O 16 49,4%
2 Bạc Argentum Ag 108
3 Nhôm Aluminium Al 27 7,5%
4 Sắt Ferrum Fe 56 4,7%
5 Canxi Calcium Ca 40 3,4%
6 Natri Natrium Na 23 2,6%
7 Kali Kalium K 39 2,3%
8 Magiê Magnesium Mg 24 1,9%
9 Hiđrô Hydrogenium H 1 1%
10 Bari Baryum Ba 137
11 Cacbon Carbonium C 12
12 Clo Clorum Cl 35.5
13 Đồng Cupruma Cu 64
14 Kẽm Zincum Zn 65
15 Lưu huỳnh Sulfur S 32
16 Nitơ Nitrogennium N 14
17 Photpho Phosphorus P 31
18 Thủy ngân Hydrargyrum Hg 201
19 Silic Silicium Si 25,8%
I. Bài ca hóa trị
Natri, Iốt, Hiđrô
Kali với Bạc, Clo một loài
Có hóa trị I em ơi
Ghi nhớ cho kỹ kẻo rồi phân vân
Magiê với Kẽm, Thủy ngân
Oxi đồng ấy cũng gần Canxi
Cuối cùng thêm chú Bari
Hóa trị II đó có gì khó khăn
Bác Nhôm hóa trị III lần
In sâu vào trí khi cần có ngay
Cácbon, Silic này đây
Là hóa trị IV chẳng ngày nào quên
Sắt kia mới thật quen tên
II, III lên xuống thật phiền lắm thôi
Lưu huỳnh lắm lúc chơi khăm
Xuống II lên VI khi nằm thứ IV
Nitơ cùng với Phốtpho,
Hóa trị V đó còn lo điều gì(*)
Ngoài ra còn có 1 số ngtố thể hiện những hóa trị khác nữa.
Các công thức thường gặp
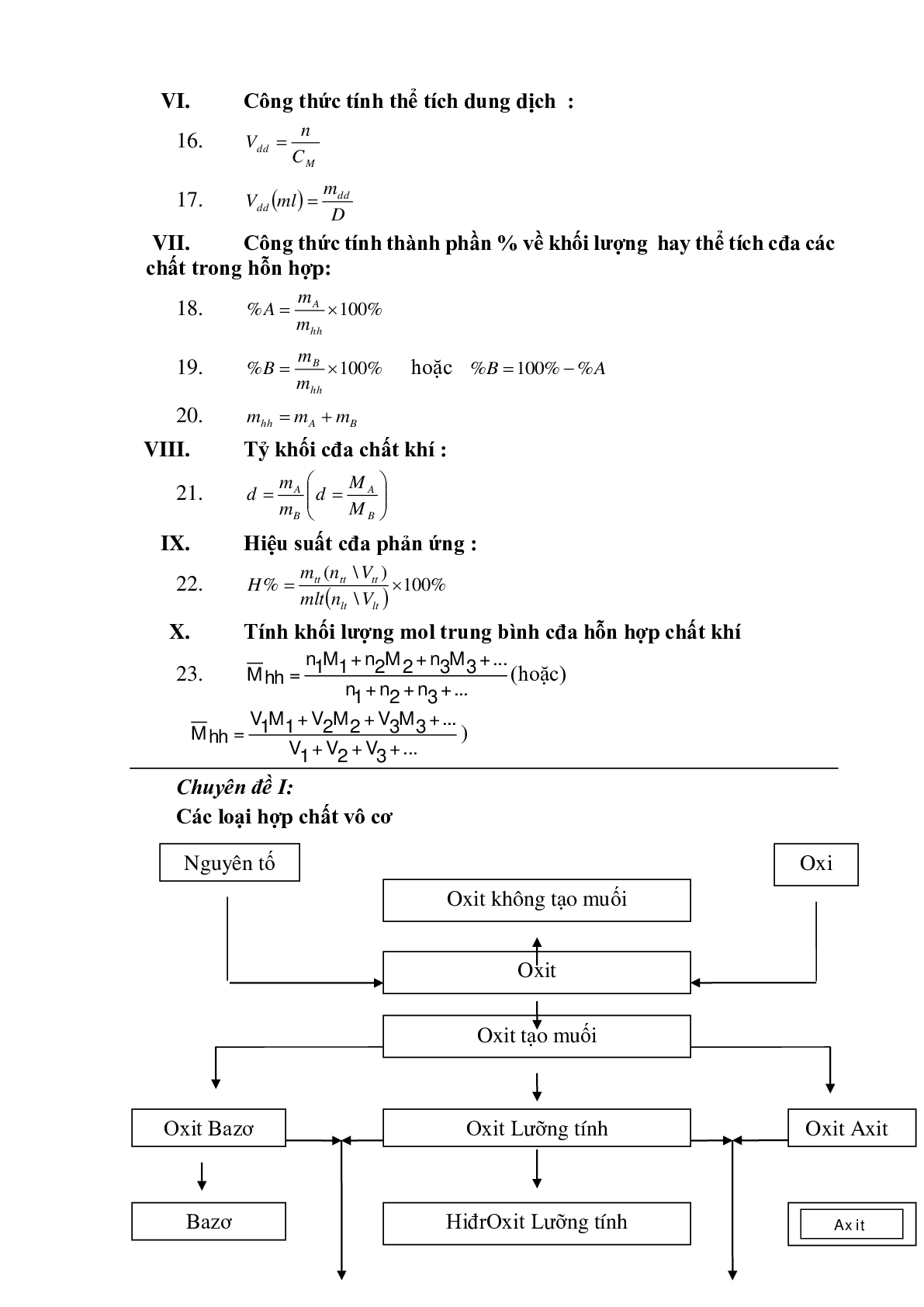
A. oxit :
I. Định nghĩa : Oxit là hợp chất gồm 2 nguyên tố, trong đó có 1 nguyên tố là oxi .
II. Phân loại: Căn cứ vào tính chất hóa học cđa oxit , người ta phân loại như sau:
1. Oxit bazơ là những oxit tác dụng với dung dịch axit tạo thành muối và nước.
2. Oxit Axit là những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
3. Oxit lưỡng tính là những oxit tác dụng với dung dịch axit và tác dụng với dung dịch baz tạo thành muối và nước. VD như Al2O3, ZnO …
4. Oxit trung tính còn được gọi là oxit không tạo muối là những oxit không tác dụng với dung dịch axit, dung dịch bazơ, nước. VD như CO, NO …
III.Tính chất hóa học :
1. Tác dụng với nước :
a. .Ví dụ :
P2O5 + 3H2O 2H3PO4
b. . Ví dụ :
2. Tác dụng với Axit :
Oxit Kim loại + Axit Muối + H2O
VD :
3. Tác dụng với Kiềm( dung dịch bazơ):
Oxit phi kim + Kiềm Muối + H2O
VD :
(tùy theo tỷ lệ số mol)
4. Tác dụng với oxit Kim loại :
Oxit phi kim + Oxit Kim loại Muối
VD :
5. Một số tính chất riêng:
VD :
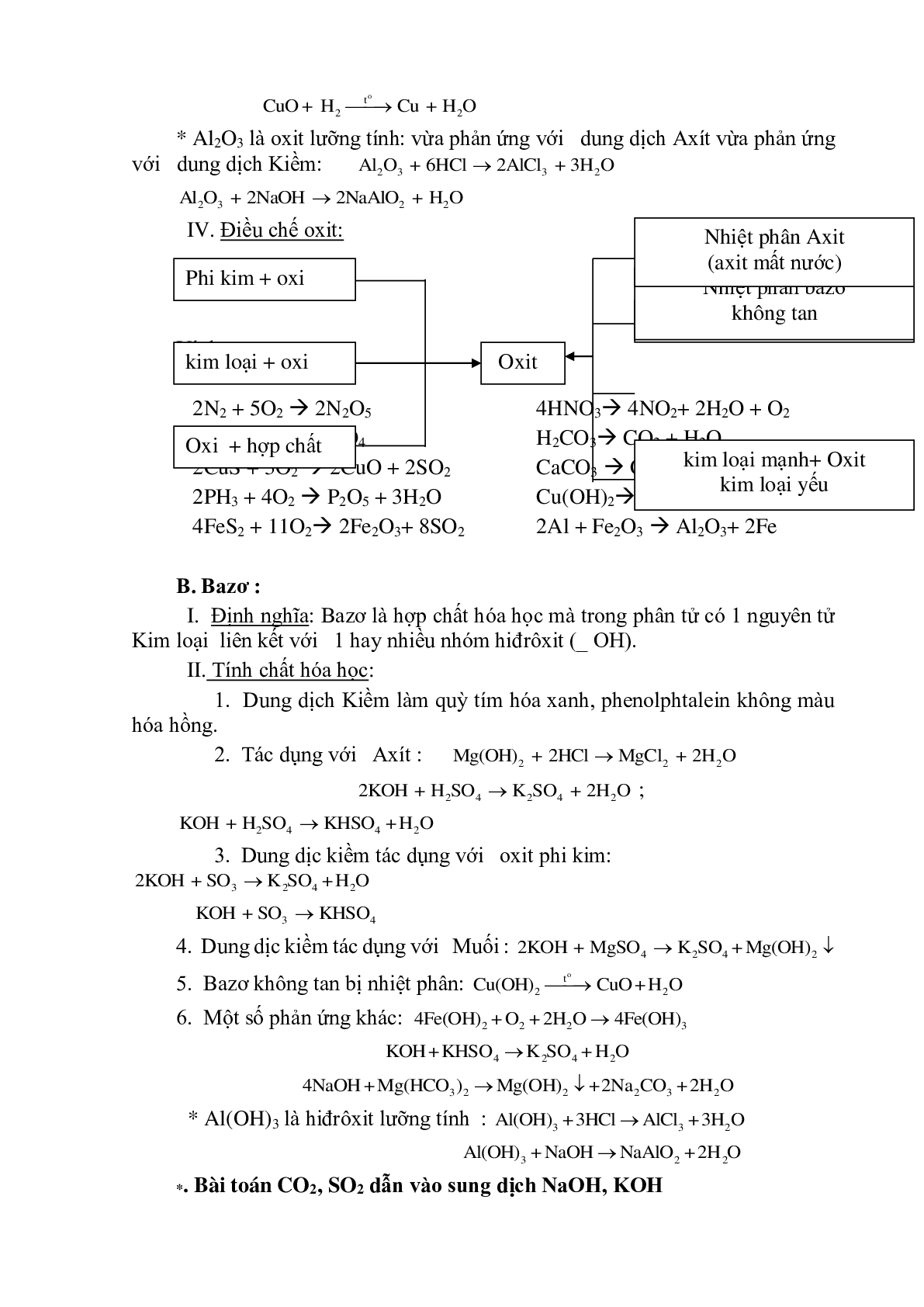
* Al2O3 là oxit lưỡng tính: vừa phản ứng với dung dịch Axít vừa phản ứng với dung dịch Kiềm:
IV. Điều chế oxit:
B. Bazơ :
I. Định nghĩa: Bazơ là hợp chất hóa học mà trong phân tử có 1 nguyên tử Kim loại liên kết với 1 hay nhiều nhóm hiđrôxit (_ OH).
II. Tính chất hóa học:
1. Dung dịch Kiềm làm quỳ tím hóa xanh, phenolphtalein không màu hóa hồng.
2. Tác dụng với Axít :
;
3. Dung dịc kiềm tác dụng với oxit phi kim:
4. Dung dịc kiềm tác dụng với Muối :
5. Bazơ không tan bị nhiệt phân:
6. Một số phản ứng khác:
* Al(OH)3 là hiđrôxit lưỡng tính :
*. Bài toán CO2, SO2 dẫn vào sung dịch NaOH, KOH
- Khi cho CO2 (hoặc SO2) tác dụng với dung dịch NaOH đều xảy ra 3 khả năng tạo muối:
k= (hoặc k= )
- k 2 : chỉ tạo muối Na2CO3
- k 1 : chỉ tạo muối NaHCO3
- 1 < k < 2 : tạo cả muối NaHCO3 và Na2CO3
* Có những bài toán không thể tính k. Khi đó phải dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
- Hấp thụ CO2 vào NaOH dư chỉ tạo muối Na2CO3
- Hấp thụ CO2 vào NaOH chỉ tạo muối Na2CO3, Sau đó thêm BaCl2 vào thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa nữa Tạo cả 2 muối Na2CO3 và NaHCO3
Trong trường hợp không có các dữ kiện trên th× chia trường hợp để giải.
Bài 1: Để hấp thụ hoàn toàn 22,4lít CO2 (đo ở đktc) cần 150g dung dịch NaOH 40% (có D = 1,25g/ml).
a) Tính nồng độ M cđa các chất có trong dung dịch (giả sử sự hòa tan không làm thay đổi thể tích dung dịch ).
b) Trung hòa lượng xút nói trên cần bao nhiêu ml dung dịch HCl 1,5M.
Bài 2: Biết rằng 1,12lít khí cacbonic (đo ở đktc) tác dụng vừa đđ với 100ml dung dịch NaOH tạo thành muối trung hòa.
a) Viết phương trình phản ứng .
b) Tính nồng độ mol cđa dung dịch NaOH đã dùng.
Bài 3: Khi cho lên men m (g) glucôzơ, thu được V(l) khí cacbonic, hiệu suất phản ứng 80%. Để hấp thụ V(l) khí cacbonic cần dùng tối thiểu là 64ml dung dịch NaOH 20% (D = 1,25 g/ml). Muối thu được tạo thành theo tỉ lệ 1:1. Định m và V? ( thể tích đo ở đktc)
Bài 4: Dung dịch có chứa 20g natri hiđrôxit đã hấp thụ hoàn toàn 11,2lít khí cacbonic (đo ở đktc) . Hãy cho biết:
a) Muối nào được tạo thành?
b) Khối lượng cđa muối là bao nhiêu?
Bài 5: Cho 100ml dung dịch natri hiđrôxit (NaOH) tác dụng vừa đđ với 1,12lít khí cacbonic (đo ở đktc) tạo thành muối trung hòa.
a) Tính nồng độ mol/l cđa dung dịch natri hiđrôxit (NaOH) đã dùng.
b) Tính nồng độ phần trăm cđa dung dịch muối sau phản ứng. Biết rằng khối lượng cđa dung dịch sau phản ứng là 105g.
Bài 6: Dẫn 1,12lít khí lưu huỳnh điôxit (đo ở đktc) đi qua 70ml dung dịch KOH 1M. Những chất nào có trong dung dịch sau phản ứng và khối lượng là bao nhiêu?
Bài 7: Cho 6,2g Na2O tan hết vào nước tạo thành 200g dung dịch.
a) Tính nồng độ phần trăm cđa dung dịch thu được.
b) Tính thể tích khí cacbonic (đo ở đktc) tác dụng với dung dịch nói trên, biết sản phẩm là muối trung hòa.
Bài 8:Dẫn 5,6 lít CO2(đkc) vào bình chứa 200ml dung dịch NaOH nồng độa M; dung dịch thu được có khả năng tác dụng tối đa100ml dung dịch KOH 1M. Giá trị của a là?
A. 0,75 B. 1,5 C. 2 D. 2,5
**. Bài toán CO2, SO2 dẫn vào dung dịch Ca(OH)2, Ba(OH)2:
Để biết khả năng xảy ra ta tính tỉ lệ k:
K=
- K 1: chỉ tạo muối CaCO3
- K 2: chỉ tạo muối Ca(HCO3)2
1 < K < 2: tạo cả muối CaCO3 và Ca(HCO3)2
- Khi những bài toán không thể tính K ta dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
- Hấp thụ CO2 vào nước vôi dư th× chỉ tạo muối CaCO3
- Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, thêm NaOH dư vào thấy có kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2
- Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, lọc bỏ kết tủa rồi đun nóng nước lọc lại thấy kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2.
- Nếu không có các dự kiện trên ta phải chia trường hợp để giải.
Khi hấp thụ sản phẩm cháy vào dung dịch bazơ nhất thiết phải xảy ra sự tăng giảm khối lượng dung dịch. Thường gặp nhất là hấp thụ sản phẩm cháy bằng dung dịch Ca(OH)2 hoặc ddBa(OH)2. Khi đó:
Khối lượng dung dịch tăng=mhấp thụ- mkết tủa
Khối lượng dung dịch giảm = mkết tủa – mhấp thụ
- Nếu mkết tủa>mCO th× khối lượng dung dịch giảm so với khối lượng dung dịch ban đầu
- Nếu mkết tủa<mCO th× khối lượng dung dịch tăng so với khối lượng dung dịch ban đầu
Khi dẫn p gam khí CO2 vào bình đựng nước vôi dư sau phản ứng khối lượng dung dịch tăng m gam và có n gam kết tủa tạo thành th× luôn có: p= n + m
Khi dẫn p gam khí CO2 vào bình đựng nước vôi sau phản ứng khối lượng dung dịch giảm m gam và có n gam kết tủa tạo thành th× luôn có: p=n - m
Bài 1: Dẫn 1,12lít khí lưu huỳnh điôxit (đo ở đktc) đi qua 700ml dung dịch Ca(OH)2 0,1M.
a) Viết phương trình phản ứng.
b) Tính khối lượng các chất sau phản ứng.
Bài 2: Cho 2,24lít khí cacbonic (đo ở đktc) tác dụng vừa đđ với 200ml dung dịch Ba(OH)2 sinh ra chất kết tđa mầu trắng.
a) Tính nồng độ mol/l cđa dung dịch Ba(OH)2 đã dùng.
b) Tính khối lượng chất kết tđa thu được.
Bài 3: Dẫn V lít CO2 (đkc) vào 300ml dd Ca(OH)2 0,5 M. Sau phản ứng thu được 10g kết tủa. Vậy V bằng: (Ca=40;C=12;O=16)
A/. 2,24 lít B/. 3,36 lít C/. 4,48 lít D/. Cả A, C đều đúng
Bài 4: Hấp thu hết CO2 vào dung dịch NaOH được dung dịch A. Biết rằng:
- cho từ từ dung dịch HCl vào dung dịch A th× phải mất 50ml dd HCl 1M mới thấy bắt đầu có khí thoát ra.
- Cho dd Ba(OH)2 dư vào dung dịch A được 7,88gam kết tủa.
dung dịch A chứa? (Na=23;C=12;H=1;O=16;Ba=137)
A. Na2CO3 B. NaHCO3 C. NaOH và Na2CO3 D. NaHCO3, Na2CO3
Bài 5:hấp thụ toàn bộ 0,896 lít CO2 vào 3 lít dd ca(OH)2 0,01M được? (C=12;H=1;O=16;Ca=40)
A. 1g kết tủa B. 2g kết tủa C. 3g kết tủa D. 4g kết tủa
Bài 6:Hấp thụ toàn bộ 0,3 mol CO2 vào dung dịch chứa 0,25 mol Ca(OH)2. khối lượng dung dịch sau phản ứng tăng hay giảm bao nhiêu gam? (C=12;H=1;O=16;Ca=40)
A. Tăng 13,2gam B. Tăng 20gam C. Giảm 16,8gam D Giảm 6,8gam
Bài 7:Hấp thụ toàn bộ x mol CO2 vào dung dịch chứa 0,03 mol Ca(OH)2 được 2gam kết tủa. Chỉ ra gía trị x? (C=12;H=1;O=16;Ca=40)
A. 0,02mol và 0,04 mol B. 0,02mol và 0,05 mol
C. 0,01mol và 0,03 mol D. 0,03mol và 0,04 mol
Bài 8: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào dung dịch nước vôi trong có chứa 0,075 mol Ca(OH)2. Sản phẩm thu được sau phản ứng gồm:
A. Chỉ có CaCO3 B. Chỉ có Ca(HCO3)2
C. CaCO3 và Ca(HCO3)2 D. Ca(HCO3)2 và CO2
Bài 9:Hấp thụ hoàn toàn 0,224lít CO2 (đktc) vào 2 lít Ca(OH)2 0,01M ta thu được m gam kết tủa. Gía trị của m là?
A. 1g B. 1,5g C. 2g D. 2,5g
Bài 10:Sục V lít khí CO2 (đktc) vào 1,5 lít Ba(OH)2 0,1M thu được 19,7 gam kết tủa. Gía trị lớn nhất của V là?
A. 1,12 B. 2,24 C. 4,48 D. 6,72
Bài 11:Hấp thụ hết 0,672 lít CO2 (đktc) vào bình chứa 2 lít dung dịch Ca(OH)2 0,01M. Thêm tiếp 0,4gam NaOH vào bình này. Khối lượng kết tủa thu được sau phản ứng là?
A. 1,5g B. 2g C. 2,5g D. 3g
Bài 12:Hấp thụ hoàn toàn 2,688 lít khí CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l thu được 15,76g kết tủa. Gía trị của a là?
A. 0,032 B. 0,048 C. 0,06 D. 0,04
Bài 13:Dung dịch A chứa NaOH 1M và Ca(OH)2 0,02M, hấp thụ 0,5 mol khí CO2 vào 500 ml dung dịch A thu được kết tủa có khối lượng?
A. 10g B. 12g C. 20g D. 28g
Bài 14:Hấp thụ hết 0,2 mol CO2 vào 1 lít dung dịch chứa KOH 0,2M và Ca(OH)2 0,05M thu được kết tủa nặng?
A. 5g B. 15g C. 10g D. 1g
Bài 15:Dung dịch X chứa NaOH 0,2M và Ca(OH)2 0,1M. Hấp thụ 7,84 lít khí CO2(đktc) vào 1 lít dung dịch X th× khối lượng kết tủa thu được là?
A. 15g B. 5g C. 10g D. 1g
Bài 16:Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l, thu được 15,76gam kết tủa. Gía trị của a là? ( ĐTTS khối A năm 2007)
A. 0,032 B. 0,048 C. 0,06 D. 0,04
Bài 17:Cho 0,14 mol CO2 hấp thụ hết vào dung dịch chứa 0,11 mol Ca(OH)2. Ta nhận thấy khối lượng CaCO3 tạo ra lớn hơn khối lượng CO2 đã dùng nên khối lượng dung dịch còn lại giảm bao nhiêu?
A. 1,84gam B. 184gam C. 18,4gam D. 0,184gam
Bài 18:Cho 0,14 mol CO2 hấp thụ hết vào dung dịch chứa 0,08mol Ca(OH)2. Ta nhận thấy khối lượng CaCO3 tạo ra nhỏ hơn khối lượng CO2 đã dùng nên khối lượng dung dịch còn lại tăng là bao nhiêu?
A. 416gam B. 41,6gam C. 4,16gam D. 0,416gam
Bài 19:Cho 0,2688 lít CO2(đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch NaOH 0,1M và Ca(OH)2 0,01M. Tổng khối lượng muối thu được là?
A. 1,26gam B. 2gam C. 3,06gam D. 4,96gam
C. AXIT :
I. Định nghĩa: Axit là hợp chất mà trong phân tử gồm 1 hoặc nhiều nguyên tử Hiđro liên kết với gốc Axit .
Tên gọi:
* Axit không có oxi tên gọi có đuôi là “ hiđric ” . HCl : axit clohiđric
* Axit có oxi tên gọi có đuôi là “ ic ” hoặc “ ơ ” .
H2SO4 : Axit Sunfuric H2SO¬3 : Axit Sunfurơ
Một số Axit thông thường:
Kớ hieọu Tên gọi Hóa trị
_ Cl Clorua I
= S Sunfua II
_ Br Bromua I
_ NO3 Nitrat I
= SO4 Sunfat II
= SO3 Sunfit II
¬_ HSO4 Hiđrosunfat I
_ HSO3 Hiđrosunfit I
= CO3 Cacbonat II
_ HCO3 Hiđrocacbonat I
PO4 Photphat III
= HPO4 Hiđrophotphat II
¬_ H2PO4 đihiđrophotphat I
_ CH3COO Axetat I
_ AlO¬¬2 Aluminat I
II.Tính chất hóa học:
1. Dung dịchAxit làm quỳ tím hóa đỏ:
2. Tác dụng với Bazụ (Phản ứng trung hòa) :
3. Tác dụng với oxit Kim loại :
4. Tác dụng với Kim loại (đứng trước hiđrô) :
5. Tác dụng với Muối :
6. Một tính chất riêng :
* H2SO4 đặc và HNO3 đặc ở nhiệt độ thường không phản ứng với Al và Fe (tính chất thụ động hóa) .
* Axit HNO3 phản ứng với hầu hết Kim loại (trừ Au, Pt) không giải phóng Hiđrô :
* HNO3 đặc nóng+ Kim loại Muối nitrat + NO2 (màu nâu)+ H2O
VD :
* HNO3 loãng + Kim loại Muối nitrat + NO (không màu) + H2O
VD :
* H2SO4 đặc nóngvà HNO3 đặc nóng hoặc loãng Tác dụng với Sắt thì tạo thành Muối Sắt (III).
* Axit H2SO4 đặc nóngcó khả năng phản ứng với nhiều Kim loại không giải phóng Hiđrô :
D. Muối :
I. Định nghĩa : Muối là hợp chất mà phân tử gồm một hay nhiều nguyên tử Kim loại liên kết với một hay nhiều gốc Axit.
II.Tính chất hóa học:
Tính chất
hóa học Muối
Tác dụng với Kim loại Kim loại + muối Muối mới và Kim loại mới
Ví dụ:
Lưu ý:
+ Kim loại đứng trước (trừ Na, K, Ca…) đẩy kim loại đứng sau (trong dãy hoạt động hóa học của kim loại) ra khỏi dung dịch muối của chúng.
+ Kim loại Na, K, Ca… khi tác dụng với dung dịch muối thì không cho Kim loại mới vì:
Na + CuSO4
2Na + 2H2O 2NaOH + H2
CuSO4 + 2NaOH Na2SO4 + Cu(OH)2
Tác dụng với Axit Muối + axít muối mới + axit mới
Ví dụ:
Điều kiện phản ứng xảy ra: Muối tạo thành không tác dụng với axit mới sinh ra hoặc axit mới sinh ra là chất dễ bay hơI hoặc axit yếu hơn axit tham gia phản ứng .
Tác dụng với Kiềm (Bazơ) Dung dịch Muối tác dụng với Bazơ tạo thành Muối mới và Bazơ mới
Ví dụ:
Điều kiện phản ứng xảy ra: Muối mới hoặc Bazơ mới tạo thành là chất không tan (kết tủa)
Tác dụng với Dung dịch Muối Dung dịch Muối tác dụng với dung dịch Muối