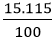Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu 4 dạng bài tập về hóa học giành cho HSG lớp 8 có chọn lọc môn Hóa học lớp 8, tài liệu bao gồm 11trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi HSG môn hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
--------------------------------------------------------------------------------------------------------------
Chuyên đề bồi dưỡng học sinh giỏi lớp 8
Chuyên đề 1: Bài tập về nguyên tử
Bài 1: Tổng số hạt p, e , n trong nguyên tử là 28 , trong đó số hạt không mang điện chiếm xấp xỉ 35%. Tính số hạt mỗi loại . Vẽ sơ đồ cấu tạo nguyên tử ?
Bài 2: Tổng số hạt trong nguyên tử R là 82 hạt .Trong nguyên tử R tổng số hạt nơtron bằng 15/13 số hạt proton. tính số hạt p, n ,e trong nguyên tử R?
Bài 3: Nguyên tử X có tổng số hạt proton ,nơtron,electron là 52 . Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt
a) Tính số hạt mỗi loại của nguyên tử X?
b) Cho biết số electron trong mỗi lớp của nguyên tử X?
c) Tính nguyên tử khối của X?
d) Tính khối lượng bằng gam của X, biết mp = mn =1,013đvC
Bài 4: Người ta kí hiệu một nguyên tử của một nguyên tố hóa học như sau :AZX , trong đó A là số hạt proton và nơtron , Z bằng số hạt proton .Cho các nguyên tử sau :
126X 168Y 136M 178R 3517A 3717E
Các nguyên tử nào thuộc cùng một nguyên tố hóa học ?Tại sao?
Bai5: Một nguyên tử X có tổng số hạt là 46 . Trong đó số hạt không mang điện bằng 8/15
Tổng số hạt mang điện . Xác định tên và kí hiệu hóa học của nguyên tử X ? Vẽ sơ đồ cấu tạo nguyên tử X?
Bài 6: Nguyên tử của một nguyên tố có tổng số hạt là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt
a) xác định số p, số e , sô n của nguyên tử đó ?
b) Vẽ sơ đồ nguyên tử , biết nguyên tử có 3 lớp e và lớp e ngoài cùng có 1e
Bài 7: Một nguyên tử R có tổng số hạt p, n, e là 115 hạt .Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt . Xác định tên và kí hiệu hóa học của nguyên tử R?
Bài 8: Một nguyên tử X có tổng số hat p ,n ,e trong nguyên tử là 46 .Biết số hạt mang điện nhiều hơn số hạt không mang điện là 14 hạt .Tính số p ,số n , trong nguyên tử Xvà cho biết X thuộc nguyên tố hóa học nao?
Chuyên đề 2: bài tâp tính theo công thức hóa học
Bài 1: Một hợp chất X gồm 3 nguyên tố C , H ,O có thành phần % theo khối lượng lần lượt là : 37,5% ; 12,5% ; 50% . Biết tỉ khối của X so với H2 bằng 16 . Tìm CTHH của X?
Bài 2: Cho biết hợp chất của nguyên tố R (hóa trị x) với nhóm SO4 có 20% khối lượng thuộc nguyên tố R
a) Thiết lập biểu thức tính nguyên tử khối của R theo hóa trị x ?
b) Hãy tính % khối lượng của nguyên tố R đó trong hợp chất của nguyên tố R với ôxi (không cần xác định nguyên tố R)
Bài 3: Hợp chất A được cấu tạo bởi nguyên tố X hóa trị V với nguyên tố ôxi. Biết phân tử khối của hợp chất A bằng 142đvC. Hợp chất B được tạo bởi nguyên tố Y (hóa trị y , 1≤ y ≤ 3) và nhóm SO4 , biết rằng phân tử khối của hợp chất A chỉ nặng bằng 0,355 lần phân tử hợp chất B. Tìm nguyên tử khối của các nguyên tố X và Y . Viết CTHH của hợp chất A và hợp chất B ?
Bài 4:
a) Tìm CTHH của ô xit sắt trong đó Fe chiếm 70 % về khối lượng
b) Khử hoàn toàn 2,4 gam hỗn hợp CuO và FexOy cùng số mol như nhau bằng hidro, thu được 1,76gam kim loại .Hòa tan kim loại đó bằng dung dịch HCl dư thấy thoát ra 0,488 lit H2 (ở đktc). Xác định CTHH của ô xit săt trên?
Bài 5: Một hợp chất gồm 3 nguyên tố : Mg , C , O có phân tử khối là 84 đvC và có tỉ lệ khối lượng giữa các nguyên tố là :mMg : mC : mO = 2 : 3 : 4 . Hãy lập CTHH của hợp chất?
Bài 6: a)Khí A chứa 80% C và 20% H . 1 lít khí A (đktc) nặng 1,34 gam . Xác định CTHH của A
b)Đốt một hợp chất Y sinh ra khí CO2 , hơI nước và khí Nitơ. Trong thành phần của Y có nguyên tố nào? Vì sao?
Bài 7 : A là một ô xít của ni tơ có phân tử khối là 92 và tỉ lệ số nguyên tử N và O là 1:2 . B là một ô xít khác của nitơ , ở đktc 1 lit khí B nặng bằng 1 lit khí CO2 . Tìm CTHH của A và B ?
Bài 8 : Một hợp chất tạo bởi C và H có tỉ lệ khối lượng mC : mH =4: 1 .Biết phân tử khối của hợp chất là 30 đvC . Hãy tìm công thức phân tử của hợp chất ?
Bài 9 : Đốt cháy hỗn hợp gồm bột Fe và S thu được hợp chất sắt sunfua. Biết 2 nguyên tố này kết hợp với nhau theo tỉ lệ khối lượng là 7 phần Fe và 4 phần S.. Tìm CTHH của hợp chất ?
Bài 10: Xác định CTHH của A và B biết rằng :
a) Đem nung 30,3 gam muối vô cơ A thì thu được 3360ml khí O2 (ở đktc) và một chất rắn có thành phần khối lượng gồm : 45,88% K , 16,48% N , 37,64 % O
b) B là một ô xit của kim loại R chưa rõ hóa trị ,biết tỉ lệ khối lượng của ô xi bằng 1/8%R
Bài 11: Tìm CTHH của một ôxít sắt biết phân tử khối là 160, tỉ lệ khối lượng của săt và ôxi là 7/3
Bài 12: Hãy tìm công thưc đơn giản nhất của một loại lưu huỳnh ôxit , biết rằng trong ôxit này có 2 gam S kết hợp với 3 gam ôxi
Bài 13: Cho biết khối lượng mol của một ôxit kim loại là 160 gam . Thành phần về khối lượng của kim loại trong ôxit là 70%. Lập CTHH của ôxit đó ?Gọi tên ôxit đó ?
Bài 14: Hãy tìm thể tích khí ôxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng :
_ Khí A có tỉ khối so với không khí là 0,552
_ Thành phần theo khối lượng của khí A là : 75% C , 25% H
Các thể tích khí đều đo ở đktc
Bài 15: Một hỗn hợp khí của nitơ gồm :NO , NO2 , NxO biết thành phần phần trăm về thể tích của các khí trong hỗn hợp là : %VNO = 50% , VNO2 = 25%. Thành phần phần trăm về khối lượng của NO trong hỗn hợp là 40% . Xác định CTHH của khí NxO?
Bài 16: Cho 2,1 gam kim loại A hóa trị I vào nước dư thu được lượng H2 nhỏ hơn 1,12 lít khí ở đktc . Nếu cho 8,2 gam kim loại A vào nước dư thì lượng H2 thoát ra vượt quá 2,24 lít (ở đktc). Xác định kim loại A?
Bài 17: Đốt cháy hoàn toàn 23 gam hợp chất A cần 33,6 lít ôxi (đktc) và thu được thể tích CO2 bằng 2/3 thể tích hơI nước . Xác định CTHH của A. Biết rằng tỉ khối hơi của A so với khí ôxi là 1,4375
Bài 18: Có 2 khí: A là hợp chất của nguyên tố X với ôxi ; B là hợp chất của nguyên tố Y với H . Trong 1 phân tử A hoặc B chỉ có một nguyên tử X hoặc Y . Trong A ôxi chiếm 50% , còn trong B Hidro chiếm 25% . Tỉ khối của A đối với B là 4 . xác định CTHH của khí A và B?
Bài 19: Lập CTHH của các ôxít có thành phần như sau: 30,43% N , còn lại là ôxi . Phân tử khối của ôxít là 46 đvC
Bài 20: tìm CTHH trong các trường hợp sau :
a) Một hợp chất có thành phần phần trăm theo khối lượng là :43,4%Na ; 11,3%C ; còn lại là O
b) Một ôxít của kim loại X chưa rõ hóa trị trong đó kim loại X chiếm 70% về khối lượng
Bài 21:
a) Ô xít của một nguyên tố hóa trị V chứa 43,67% nguyên tố đó .Xác định CTHH của ôxit?
b) Ôxít của một nguyên tố hóa trị III chứa 17,29%O. Xác định CTHH của ôxít đó ?
c) Ôxít của một nguyên tố hóa trị IV chứa 13,4% khối lượng ôxi.Xác định CTHH của ôxit?
Bài 22: Chobiết tỉ lệ khối lượng của các nguyên tử trong hợp chất cacbon đisunfua là 3/16 . Hãy tính tỉ lệ số nguyên tử C và S trong hợp chất cacbon đisunfua, tỉ lệ này có phù hợp với công thức hóa học của hợp chất CS2 không?
Bài 22:
a) Một ôxít của nitơ có phân tử khối là 108 , biết mN : mO = 7: 20. Tìm CTHH của ôxít đó ?
b) Khi ôxi hóa một nguyên tố hóa học có hóa trị IV bằng ôxi người ta thu được 2,54 gam ôxít .Xác định nguyên tố đó
c) Một loại sắt clorua chứa 44% Fe còn lại là Cl . Tính hóa trị của nguyên tố Fe trong hợp chất
d) Hợp kim đồng và nhôm là 1 hợp chất hóa học chứa 12,3% nhôm . Hãy tìm CTHH đơn giản nhất của hợp chất đó ?
Bài 23:
a) Xác định CTHH một ôxít của nhôm , biết tỉ lệ khối lượng của 2 nguyên tố nhôm và ôxi là: 4,5 : 4
Chuyên đề 3: bài tập về phương trình hóa học
Bài 1: Hoàn thành các PTHH sau và cho biết tỉ lệ số nguyên tử , số phân tử của các chất :
1. K + ? -----> K2S 3. Cu + AgNO3 -----> ? + Ag
2. Fe3O4 + ? ----> Al2O3 + Fe 4. NaOH + FeCl2 -----> ? + NaCl
Bài 2: Hoàn thành các PTPƯ sau:
1. Fe2O3 + CO --------> ? + ?
2. AgNO3 + Al --------> Al(NO)3 + ?
3. HCl + CaCO3 --------> CaCl2 + H2O
4. C4H10 + O2 --------> CO2 + H2O
5. NaOH + Fe2(SO4)3 --------> Fe(OH)3 + Na2SO4
6. FeS2 + O2 -------> Fe2O3 + SO2
7. KOH + Al2(SO4)3 -----> K2SO4 + Al(OH)3
8. CH4 + O2 + H2O ------> CO2 + H2
9. Al + Fe3O4 ------> Al2O3 + Fe
10. FexOy + CO ------> FeO + CO2
Bài 3: Viết các PTHH thực hiện dãy chuyển đổi sau:(ghi điều kiện phản ứng nếu có ):
a) KClO3 ----> O2 ----> CuO ------> H2O -----> NaOH
b) Cu(OH)2 ---> H2O ----> H2 ----> Fe -----> FeSO4
Bài 3: Hoàn thành các PTHH theo các sơ đồ sau và cho biết mỗi phản ứng thuộc loại nào ? (Ghi rõ điều kiện nếu có )
1. Fe2O3 + CO -----> FexOy + ?
2. KMnO4 ------> ? + MnO2 + ?
3. Al + FexOy -------> Fe + ?
4. Fe + O2 ------ > FexOy
5. ? + H2O -------> NaOH
6. Zn + ? ------> ZnCl2 + ?
7. CuO + H2 ------> Cu + H2O
8. FeS + O2 ------> Fe2O3 + SO2
9. Fe3O4 + HCl ------> ? + ? + ?
10. CxHy + O2 ------> CO2 + H2O
11. FexOy + HCl -----> FeCl2y/x + H2O
12. KOH + Al2(SO4)3 ------> K2SO4 + Al(OH)3
13. CnH2n-2 + ? ------> CO2 + H2O
14. FeS2 + O2 -------> Fe2O3 + SO2
13. Al + HNO3 -------> Al(NO3)3 + N2O + H2O
14. CaO + H3PO4 --------> Ca3(PO4)2 + H2O
15. Fe3O4 + HCl ----------> FeCl3 + FeCl2 + H2O
16. FexOy + HCl ----------> FeCl2y/x + H2O
17. Fe2O3 + CO -----------> ? + ?
18. Al + AgNO3 ----------> ? + ?
19. CaCO3 + HCl --------> CaCl2 + H2O + ?
20. NaOH + Fe2(SO4)3 --------> Fe(OH)3 + ?
21. FeS2 + O2 -----------> Fe2O3 + SO2
22. CH4 + O2 + H2O ---------> CO2 + H2
23. Al + Fe3O4 --------> Fe + ?
24. FexOy + CO ---------> FeO + CO2
25. Mg + HNO3 ------ --> Mg(NO3)2 + N2O + H2O
26. Fe + H2SO4(đặc nóng) ---------> Fe2(SO4)3 + SO2 + H2O
27. Fe3O4 + HNO3(loãng) ---------> Fe(NO3)3 + NO + H2O
28. Zn + H2SO4(đặc,,nóng) --------> ZnSO4 + H2S + H2O
29. KMnO4 + HCl ------> KCl + MnCl2 + Cl2 + H2O
30. Al + NaOH + H2O -------> NaAlO2 + H2
31. Cu(NO3)2 --------> CuO + NO2 + O2
32. NaOH + Cl2 -------> NaCl + NaClO + H2O
33. CnH2n+2 + O2 -------> CO2 + H2O
34. FexOy + HNO3 --------> Fe(NO3)3 + NO + H2O
Chuyên đề 4: bàI tập tính theo pthh
Bài 1: ở cùng điều kiện nhiệt độ và áp suất : a mol khí H2 (khối lượng 4 gam )và x mol khí cacbonic có khối lượng y gam chiếm thể tích bằng nhau
a) Tính x và y?
b) Tính số nguyên tử và số phân tử trong mỗi lượng chất trên?
Bài 2:
Hòa tan hoàn toàn 9,6 gam một kim loại X có hóa trị II bằng dung dịch HCl vừa đủ .Khi phản ứng kết thúc thu được 8,96 lít khí (đktc)
a) Xác định tên kim loại X?
b) Tính thể tích dung dịch HCl 1 M cần dùng cho phản ứng trên?
Bài 3:
Để khử hoàn toàn 47,2 gam hỗn hợp CuO , FeO, Fe3O4 cần dùng V lít khí H2 (ở đktc).Sau phản ứng thu được m gam kim loại và 14,4 gam nước
a) Viết PTHH xảy ra?
b) Tính giá trị m và V?
Bài 4:
Cho 21,6 gam hỗn hợp kim loại M và M2O3 nung ở nhiệt độ cao , rồi dẫn luồng khí CO dư đi qua để phản ứng xảy ra hoàn toàn thu được m gam kim loại và 6,72 lít khí CO2 (ở đktc)
a) Xác định kim loại M và ôxít M2O3 , gọi tên các chất đó?
b) Tìm m biết tỉ lệ số mol của M và M2O3 là 1:1?
Bài 5:
Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng vừa đủ thu được dung dịch A và V lít khí ở đktc . Tính khối lượng chất tan có trong dung dịch A?
Bài 6:
Đốt cháy 11,2 lít H2 trong 11,2 lít khí O2 (đktc) để tạo thành nước . Tính:
a) Chất nào còn thừa sau phản ưng và khối lượng còn thừa là bao nhiêu ?
b) Tính khối lượng sản phẩm thu được sau phản ứng ?
Bài 7 :
Cho a gam hỗn hợp 2 kim loaị A và B (chưa rõ hoá trị ) tác dụng hết với dung dịch HCl ( cả A và B đều phản ứng ) .Sau khi phản ứng kết thúc , người ta chỉ thu được 67 gam muối và 8,96 lít H2(ở đktc)
a) Viết các PTHH xảy ra?
b) Tính a?
Bài 8:
Đốt cháy hoàn toàn 10,8 gam kim loại R (chưa rõ hóa trị ) cần dùng vừa đủ lượng ôxi sinh ra khi phân hủy hàn toàn 94,8 gam KMnO4. Xác định kim loại R?
Bài 9:
Khử hoàn toàn 32 gam hỗn hợp gồm CuO và một ôxít sắt bằng khí H2 dư ở nhiệt độ cao . Sau phản ứng thu được hỗn hợp chất rắn , cho hỗn hợp rắn này tac dụng hoàn toàn với axít H2SO4 loãng thâý thoát ra 6,72 lít khí (ở đktc) và 6,4 gam chất rắn .
a) Tìm CTHH của ôxít sắt đó ?
b) Tính thành phần % theo khối lượng của mỗi ôxít trong hỗn hợp ban đầu ?
Bài 10:
Cho 43,7 gam hỗn hợp 2 kim loại Zn và Fe tác dụng với dung dịch HCl sinh ra 15,68 lít khí H2 (ở đktc)
a)Tính khối lượng mỗi kim loại trong hỗn hợp trên ?
b) Tính khối lượng sắt sinh ra khi cho toàn bộ khí H2 thu được ở trên tác dụng hoàn toàn với 46,4 gam Fe3O4?
Bài 11:(Quế võ 2009)
Đốt cháy hoàn toàn 4,48 lít khí H2 trong 3,36 lít O2 . Ngưng tụ sản phẩm thu được chất lỏng A và khí B. Cho toàn bộ khí B phản ứng hết với 5,6 gam Fe thu được hỗn hợp chất rắn C. Hòa tan toàn bộ chất rắn c vào dung dịch chứa 14,6 gam HCl thu được dung dịch D và khí E.
Xác định các chất có trong A,B,C,D,E .Tính khối lượng mỗi chất có trong A và C và số mol các chất có trong dung dịch D?
Biết : Fe + O2 -----> Fe3O4
Fe + HCl ------> FeCl2 + H2
Fe3O4 + HCl ------->FeCl2 + FeCl3 + H2O
Bài 12:
Nung 400 gam đá vôi chứa 90% CaCO3 , phần còn lại là đá trơ . Sau một thời gian thu được chất rắn X và khí Y
a) Tính khối lượng chất rắn X biết hiệu suất phản ứng phân hủy CaCO3 là 75%?
b) Tính % khối lượng CaO trong chất rắn X và thể tích khí Y thu được ?
Bài 13: (Quế võ 2012)
Đặt cốc A đựng dung dịch HCl và cốc B đựng dung dịch H2SO4 loãng vào 2 đĩa cân sao cho cân ở vị trí thăng bằng . Sau đó làm thí nghiệm như sau :[
-Cho 11,2 gam Fe vào cốc đựng dung dịch HCl
- cho m gam Al vào cốc đựng dung dịch H2SO4
Khi cả Fe và Al đều tan hoàn toàn thấy cân ở vị trí thăng bằng .Tính m?
Bài 14:
Cho luồng khí hiđrô đi qua ống thủy tinh chứ 20 gam bột đồng (II) ôxít ở 400oC .Sau phản ứng thu được 16,8 gam chất rắn
a) Nêu hiện tượng phản ứng xảy ra?
b) Tính thể tích khí hiđrô tham gia phản ứng trên ở đktc
Bài 15:(Quế võ 2009)
Thực hiện nung a gam KClO3 và b gam KMnO4 để thu khí ôxi . Sau khi phản ứng xảy ra hoàn toàn thì thấy khối lượng các chất còn lại sau phản ứng bằng nhau
a) Tính tỉ lệ a/b?
b) Tính tỉ lệ thể tích khí ôxi tạo thành của 2 phản ứng ?
Bài 16:
Đốt cháy hoàn toàn 2,4 gam một kim loại đơn hóa trị ta thu được 4 gam ôxít .Xác định tên kim loại đó ?
Bài 17. Khử hoàn toàn 24gam hỗn hợp CuO và FexOy bằng H2 thu được 17,6 gam hỗn hợp 2 kim loại .Cho toàn bộ 2 kim loại trên phản ứng với dung dịch HCl dư thu được 4,48 lít H2 (đktc). Xác định CTHH của ôxít sắt ?
Bài 18:
Hòa tan hoàn toàn 6,5 gam Zn vào dung dịch HCl ta thu được muối ZnCl2 và thấy có khí H2 thoát ra . Cho toàn bộ lượng khí H2 thu được qua 6 gam CuO đun nóng , sau phản ứng thu được 5,2 gam chất rắn . Tính hiệu suất phản ứng ?
Bài 19:
Khử hoàn toàn 2,4 gam hỗn hợp CuO và FexOy cùng số mol như nhau bằng khí H2 thu được 1,76 gam kim loại . Hòa tan kim loại đó bằng dung dịch HCl dư thấy thoát ra 0,448 lít H2 (đktc) . Xác định CTHH của ôxít sắt?
Bài 20:
Thổi từ từ 0,56 lít CO (đktc) vào ống đựng 1,44 gam bột FeO đun nóng .Khí thu được sau phản ứng được dẫn từ từ qua bình đựng dung dịch nước vôi trong dư ( để toàn bộ CO2 hấp thụ hết )thì thu được 1 gam kết tủa màu trắng .
a) Tính khối lượng chất rắn thu được sau phản ứng ?
b) Tính thể tích khí thu được sau phản ứng?
c) Có kết luận gì về phương trình phản ứng trên ( xảy ra hoàn toàn hay không hoàn toàn )
Bài 21:
Những hợp chất sau đây có thể điều chế ôxi trong PTN : KMnO4 , KClO3 , KNO3, HgO. Tính thể tích ôxi thu được (đktc) khi phân hủy :
a) 0,5 mol mỗi chất trên?
b) 50 gam mỗi chất KNO3 hoặc HgO
Bài 22:
Cho 15,6 gam Zn vào dung dịch H2SO4 loãng chứa 39,2 gam H2SO4
a) Tính thể tích H2 thu được (đktc). Biết rằng thể tích H2 bị hao hụt 5%
b) Chất nào còn dư sau phản ứng ? Khối lượng còn dư là bao nhiêu gam?
Bài 23:
Trộn H2 và O2 theo tỉ lệ về khối lượng mH : mO = 1: 4 ta được hỗn hợp khí A . Cho nổ hỗn hợp khí A thì thấy thể tích khí còn lại là 3,36 lít (đktc) .Tính thể tích của hỗn hợp khí A(đktc)
Bài 24:
Đun nóng hỗn hợp A dạng bột có khối lượng 39,3 gam gồm các kim loại Mg, Al ,Fe và Cu trong không khí dư ôxi đến khi thu được hỗn hợp rắn có khối lượng không đổi là 58,5 gam
Viết các PTHH biểu diễn các phản ứng xảy ra và tính thể tích khí ôxi (đktc) đã tác dụng với hỗn hợp kim loại ?
Bài 25:
Hỗn hợp khí B gồm CO, CO2,và H2 . Nếu đốt cháy hoàn toàn 4,48 lít hỗn hợp khí B cần dùng 14,56 lít khí O2 . Biết rằng 4,48 lít khí B có khối lượng 46,4 gam
Hãy tính % thể tích mỗi khí trong B ( các thể tích đều đo ở đktc)
Bài 26:
Nêu các hiện tượng xảy ra trong các trường hợp sau và viết PTHH để giải thích? Cho biết các phản ứng đó thuộc loại phản ứng hóa học nào?
a) Đốt phốt pho trong lọ chứa sẵn một ít nước cất sau đó đậy nút lại rồi lắc đều cho đến khi khói trắng tan hết vào trong nước . Cho mẩu quỳ tím vào dung dịch trong lọ ?
b) Cho Zn vào dung dịch H2SO4 loãng , dẫn khí sinh ra vào ống nghiệm chứa sẵn một ít O2. Đưa ống nghiệm lại gần ngọn lửa đèn cồn
c) Cho một mẩu Na vào cốc nước để sẵn giấy quỳ tím
.
Bài 27:
Cho 60,5 gam hỗn hợp 2 kim loại Kẽm và Sắt tác dụng hết với dung dịch HCl. Thành phần % theo khối lượng của Sắt trong hỗn hợp là 46, 2895. Tính:
a) Khối lượng mỗi kim loại trong hỗn hợp
b) Thể tích khí Hidro ở ( ĐKTC) thu được?
c) Khối lượng của các muối tạo thành?
Bài 28:
1) Cho 3,6 . 1023 phân tử MgO phản ứng với axit Clohidric theo sơ đồ phản ứng:
. MgO + HCl MgCl2 + H2O
a) Tính số phân tử HCl cần dùng để phản ứng xảy ra hoàn toàn.
b) Tính số phân tử muối MgCl2 được tạo thành.
c) Tính số nguyên tử H và O được tạo thành.
2) Cho 1,68 gam kim loại hóa trị II tác dụng với lượng dư dung dịch HCl. Sauk hi phản ứng xong nhận thấy khối lượng dung dịch sau phản ứng nặng hơn khối lượng dung dịch ban đầu là 1,54 gam.
Xác định công thức hóa học kim loại đã dùng.
Bài 29:
Có V lít hỗn hợp khí gồm CO và H2. Chia V lít hôn hợp thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần thứ nhất bằng khí O2, sau đó dẫn sản phẩm đI qua nuwocs vôI trong dư thu được 20 gam kết tủa trắng.
Dẫn phần thứ 2 đi qua bột CuO nóng dư, phản ứng xong thu được 19,2 gam kim loại Cu.
a) Viết PTHH.
b) Tính thể tích của V( lít) hỗn hợp khí ở ( ĐKTC) ban đầu?
c) Tính thành phần % của hỗn hợp khí ban đầu theo thể tích và theo khối lượng?
Bài 30:
1) Cho 43,7 gam hỗn hợp 2 kim loại Zn và Fe tác dụng với dung dịch HCl sinh ra 15,68 lít H2 ở ĐKTC.
a) Tính khối lượng mỗi kim loại trong hỗn hợp trên?
b) Tính khối lượng Fe sinh ra khi cho toàn bộ khí H2 thu được ở trên tác dụng hoàn toàn với 46,4 gam Fe3O4.
2) Hòa tan a( gam) Al và b (gam) Zn vào dung dịch H2SO4 dư thu được những thể tích khí bằng nhau. Tính tỉ lệ a/b?
Bài 31:
1. Tính số phân tử có trong 34,2 gam Al2(SO4)3 .ở đktc , bao nhiêu lit khí ôxi sẽ có số phân tử bằng số phân tử có trong Al2(SO¬4)3 ở trên?
2. Dẫn V lít hỗn hợp khí ở đktc gồm CO và H2 phản ứng với lượng dư hỗn hợpgồm CuO và Fe3O4 nung nóng . Sau khi phản ứng xảy ra hoàn toàn hỗn hpj chất rắn thu được giảm 0,32 gam . Tính V?
3. Đốt cháy hoàn toàn hỗn hợp gồm 3 kim loại Mg , Cu ,và Al trong không khí thấy khối lượng tăng 7,2 gam
a) Viết PTHH?
b) Tính thể tích không khí phải dùng ở đktc. Biết ôxi chiếm 1/5 thể tích không khí?
c) Khối lượng mỗi kim loại có trong hỗn hợp ban đầu .Biết khối lượng O2 phản ứng của 3 chất đều bằng nhau?
Bài 32:
Bốn bình có thể tích và khối lượng bằng nhau , mỗi bình đựng trong các khí sau : hiđrô , ôxi , nitơ, cácboníc . Hãy cho biết :
a) Số phần tử của mỗi khí có trong bình có bằng nhau không?Giải thích?
b) Số mol chất có trong mỗi bình có bằng nhau không ? GiảI thích?
c) Lượng khí có trong mỗi bình có bằng nhau không? Nếu không bằng nhau thì bình đựng khí nào có khối lượng lớn nhất , nhỏ nhất?
Biết các khí trên đều ở cùng nhiệt độ và áp suất
Bài 33:
Người ta sản xuất sắt từ quặng pirit theo sơ đồ sau :
+ O2 + CO
FeS Fe2O3 Fe
a) Viết PTHH biểu diễn sơ đồ trên?
b) Người ta dùng 120 tấ quặng pirít có chứa 10% tạp chất để sản xuất Feta thu được 48 tấn Fe. Tính hiệu suất phản ứng trên?
Bài 34:
Đốt cháy m gam hỗn hợp gồm S và P và một lượng khí trơ không cháy trong bình chứa ôxi vừa đủ . Sau phản ứng tạo thành 69,6 gam hỗn hợp gồm một chất bột bámvào bình và 1 chất khí mùi hắc khó thở
a) Viết PTHH phản ứng xảy ra
b) Tính thành phần % khối lượng của S và P trong hỗn hợp ban đầu chứa 20% tạp chất và số mol dạng chất bột thu được gấp 2 lần số mol dạng chất khí
Bài 35:
1. Tính khối lượng của từng nguyên tố trong 37,6 gam Cu(NO3)2
2. Tính số phân tử , nguyên tử của tong nguyên tố trong 92,8 gam Fe3O4
Bài 36:
Để khử hoàn toàn 40 gam hỗn hợp gồm CuO và Fe2O3 ở nhiệt độ cao cần dùng 13,44 lít H2 (đktc)
a) Tín khối lượng mỗi chất trong hỗn hợp đầu?
b) Tính thành phần % theo khối lượng của mỗi chát trong hỗn hợp đầu?
Bài 37:
1. Đốt cháy 25,6 gam Cu thu được 28,8 gam chất rắn X . Tính khối lượng mỗi chất trong X?
2. Cho 2,4 gam kim loại hóa trị II tác dụng với dung dịch HCl lấy dư , sau khi phản ứng kết thúc thu được 2,24 lít H2 (đktc) . Xác định kim loại ?
Bài 38:
1. Đốt cháy 12,15 gam Al trong bình chứa 6,72 lít O2 (đktc)
a) Chất nào conf dư sau phản ứng?Khối lượng còn dư là bao nhiêu?
b) Chất nào được tạo thành ? Có khối lượng là bao nhiêu
UỶ BAN NHÂN DÂN HUYỆN
PHÒNG GD&ĐT HUYỆN đề thi Học Sinh Giỏi
môn hóa 8
Năm học 2011-2012
(Thời gian làm bài: 150 phút)
Bài 1.
Câu 1. Hãy đọc tên các muối sau: NaHCO3, MgSO4, CuS, Ca(H2PO4)2 , FeCl3, Al(NO3)3
Câu2. Hãy giải thích vì sao:
a. Khi nung miếng đồng ngoài không khí thì thấy khối lượng tăng lên
b. Khi nung nóng canxicacbonat thấy khối lượng giảm đi.
Câu 3. Hoàn thành các PTHH sau:
a. FeS2 + O2 → ? + ? b. NaOH + ? → NaCl + H2O
c. Fe(OH)3 → ? + ? d. CH4 + ? → CO2 + H2O
e. Fe + Cl2 → ?
Bài 2.
Lập phương trình hoá học của các phản ứng theo sơ đồ sau:(ghi rõ điều kiện phản ứng nếu có)
a) Fe(OH)2 + O2 + H2O Fe(OH)3 b) Fe3O4 + Al Fe + Al2O3
c) FexOy + HCl … + H2O d) FexOy + CO Fe + CO2
e) CnH2n+2 + O2 CO2 + H2O f) FeS2 + O2 Fe2O3 + SO2
Bài 3. Cho 2 cốc đựng 2 dung dịch HCl và H2SO4 loãng vào 2 đĩa cân sao cho cân ở vị trí thăng bằng. Sau đó làm thí nghiệm như sau:
- Cho 25,44g Na2CO3 vào cốc đựng dung dịch HCl
- Cho m g Al vào cốc đựng dung dịch H2SO4
Cân ở vị trí thăng bằng. Tính m?. (Cho biết các phản ứng xảy ra hoàn toàn và
Na2¬CO3 + HCl 2NaCl + H2O + CO2)
Bài 4. 1. Trộn 300ml dung dịch NaOH 1M với 200ml dung dịch NaOH 1,5M. Hãy tính nồng độ mol và nồng độ phần trăm của dung dịch thu được, biết khối lượng riêng của dung dịch này là 1,05g/ml.
2. Cho dung dịch H2SO4 3M. Với những dụng cụ đã cho trong phòng thí nghiệm em hãy trình bày cách pha chế 200g dung dịch H2SO4 9,8%
Bài 5. Đốt cháy hoàn toàn 68g hỗn hợp hiđro và các bon oxít, người ta dùng hết 89,6 lít oxi.
a/. Viết PTHH.
b/. Tính thành phần % về khối lượng và % về thể tích của mỗi khí có trong hỗn hợp (khí ở đktc).
c/. Bằng phương pháp hoá học làm thế nào để nhận ra mỗi khí H2 và CO riêng biệt.
Bài 6. 1, CaO thường được dùng làm chất hút ẩm (hút nước). Tại sao phải dùng vôi tôi sống mới nung?
2, Nêu hiện tượng và viết phương trình hóa học xảy ra khi hòa tan Fe bằng HCl và sục khí Cl2 đi qua hoặc cho KOH vào dung dịch để lâu ngoài không khí.
3, Mỗi hỗn hợp khí cho dưới đây có thể tồn tại được hay không? Nếu tồn tại thì cho biết điều kiện? Nếu không tồn tại thì chỉ rõ nguyên nhân:
a, H2 và O2; b, O2 và Cl2; c, H2 và Cl2; d, SO2 và O2.
Bài 7. Cho các muối sau: KCl, AgCl, BaSO4, CaCO3, MgCl2, những muối nào không tan trong nước?
Lời giải:
- Phần lớn các muối clorua, sunfat đều tan trừ một số muối như AgCl, BaSO4, CaSO4...
- Phần lớn các muối cacbonat không tan trừ muối natri, kali
⇒ Những muối không tan trong nước là: AgCl, BaSO4, CaCO3
Bài 8. Biết 90 gam NaCl hòa tan trong 250 ml nước thì thu được dung dịch bão hòa (DH2O = 1 g/ml) ở 25oC. Tính độ tan trong nước của NaCl ở 25oC ?
Lời giải:
mH2O = D.V = 1. 250 = 250g
Công thức tính độ tan: S = 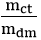
Độ tan trong nước của NaCl ở 25oC là: S = 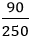
Bài 9. Ở 40oC, hòa tan m gam K2SO4 vào 115 gam nước thì được dung dịch bão hòa. Biết độ tan của K2SO4 ở nhiệt độ 40oC là 15gam. Giá trị của m là bao nhiêu?
Lời giải:
S = 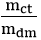
Khối lượng K2SO4 cần hòa tan vào 95 gam nước để thu được dung dịch bão hòa là:
m =