Tổng số hạt cơ bản của nguyên tử X là 13. Cấu hình electron của nguyên tử X là
A. 1s22s22p3
B. 1s22s22p2
C. 1s22s22p1
D. 1s22s2
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án: D
Với các nguyên tử bền ta có: 1 ≤ ≤ 1,52 (1)
Theo bài ra có:
2Z + N = 13 ⇒ N = 13 – 2Z, thay vào (1) ta có:
⇔ Z ≤ 13 – 2Z ≤ 1,52Z
⇔ 3,69 ≤ Z ≤ 4,33
Chọn Z = 4 ⇒ N = 5
⇒ Cấu hình electron của nguyên tử X là 1s22s2
Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Cấu hình electron của nguyên tử cho biết số lớp electron, thứ tự phân lớp electron và số electron trong mỗi lớp và mỗi phân lớp.
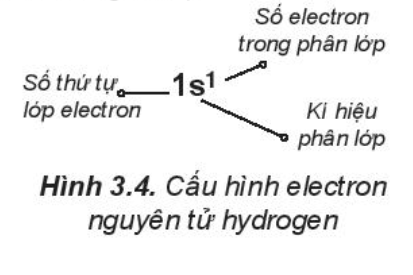
1. Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s 2s 2p 3s 3p 4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
Ví dụ 1: Viết cấu hình electron của nguyên tử nitrogen (Z = 7).
- Tổng số electron của nguyên tử N là 7.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p3.
- Có thể thay 1s2 bằng kí hiệu [He]. Cấu hình electron của nguyên tử N là 1s22s22p3 hoặc [He]2s22p3 hoặc (2, 5).
Electron cuối cùng điền vào phân lớp p nên nitrogen là nguyên tố p.
Ví dụ 2: Viết cấu hình electron của nguyên tử potassium (Z = 19).
- Tổng số electron của nguyên tử K là 19.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p63s23p64s1.
- Có thể thay 1s22s22p63s23p6 bằng kí hiệu [Ar]. Cấu hình electron của nguyên tử K là 1s22s22p63s23p64s1 hoặc [Ar]4s1 hoặc (2, 8, 8, 1).
Electron cuối cùng điền vào phân lớp s nên potassium là nguyên tố s.
2. Biểu diễn cấu hình electron theo ô orbital
Ví dụ: Cấu hình electron của nguyên tử nitrogen có Z = 7: 1s22s22p5 có thể được biểu diễn theo ô orbital như sau:
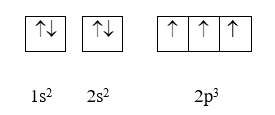
Hai ô orbital 1s và 2s có đủ 2 electron được biểu diễn bằng hai mũi tên ngược chiều nhau (nguyên lí Pauli). 3 electron còn lại được sắp xếp vào 3 orbital 2p bằng 3 mũi tên đi lên để số electron độc thân là tối đa (quy tắc Hund).
3. Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
- Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
- Các nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim.
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.
Xem thêm một số kiến thức liên quan:
20 câu Trắc nghiệm Mở đầu (Kết nối tri thức) có đáp án – Hóa học lớp 10
Lý thuyết Thành phần của nguyên tử (Kết nối tri thức) hay, chi tiết | Hóa học 10
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 82. Số hạt mang điện nhiều hơn số hạt không mang điện là 22.
a) Viết kí hiệu nguyên tử của nguyên tố X.
b) Xác định số lượng các hạt cơ bản trong ion X2+ và viết cấu hình electron của ion đó.
Anion X2- có cấu hình electron là 1s22s22p6. Cấu hình electron của X là
Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6. Tổng số electron ở lớp vỏ của X2- là
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M là
Nguyên tử của nguyên tố X có cấu hình electron đã xây dựng đến phân lớp 3d2. Tổng số electron của nguyên tử nguyên tố X là
Ion O2- không có cùng số electron với nguyên tử hoặc ion nào sau đây?
Nguyên tử của nguyên tố M có số hiệu nguyên tử bằng 20. Cấu hình electron của ion M2+ là
Nguyên tố X được sử dụng rộng rãi trong đời sống: đúc tiền, làm đồ trang sức, làm răng giả, ... Muối iodine của X được sử dụng nhằm tụ mây tạo ra mưa nhân tạo. Tổng số hạt cơ bản trong nguyên tử nguyên tố X là 155, số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. Xác định nguyên tố X.
Nguyên tử của nguyên tố Y có 14 electron ở lớp thứ ba. Thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng là: 1s2s2p3s3p4s3d ...
Cấu hình electron của nguyên tử Y là
Nguyên tố Q có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố Q điền vào lớp, phân lớp nào sau đây?
Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p1. Nguyên tử của nguyên tố Y có electron cuối cùng điền vào phân lớp 3p3. Số proton của X và Y lần lượt là