Hợp chất có chứa liên kết ion là?
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: D
Liên kết ion là một loại liên kết hóa học hình thành giữa các ion mang điện tích trái dấu, thường là giữa một kim loại và một phi kim. Trong liên kết này, nguyên tử kim loại nhường electron để trở thành ion dương (cation), trong khi nguyên tử phi kim nhận electron để trở thành ion âm (anion). Lực hút tĩnh điện giữa các ion trái dấu này tạo thành liên kết ion.
A. HCl: Đây là hợp chất cộng hóa trị phân cực, không phải liên kết ion.
B, N2: Là phân tử đơn chất, gồm 2 nguyên tử nitơ liên kết với nhau bằng liên kết cộng hóa trị.
C. CO2: Là phân tử cộng hóa trị, gồm 1 nguyên tử cacbon liên kết với 2 nguyên tử oxi bằng liên kết cộng hóa trị.
D. BaCl2: Ba là kim loại kiềm thổ, Cl là phi kim halogen. Khi kết hợp, Ba nhường 2 electron cho 2 nguyên tử Cl, tạo thành ion Ba²⁺ và 2 ion Cl⁻. Lực hút tĩnh điện giữa các ion này tạo thành liên kết ion. Hợp chất có chứa liên kết ion là BaCl2 vì Ba là kim loại điển hình và Cl là phi kim điển hình.
Lý thuyết Liên kết ion
I. Ion và sự hình thành liên kết ion
1. Sự tạo thành ion
- Khi nhường electron, nguyên tử trở thành ion dương (cation)
Ví dụ:
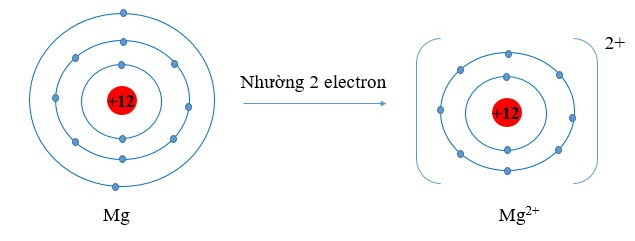
Viết gọn: Mg → Mg2+ + 2e
- Khi nhận electron, nguyên tử trở thành ion âm (anion)
Ví dụ:
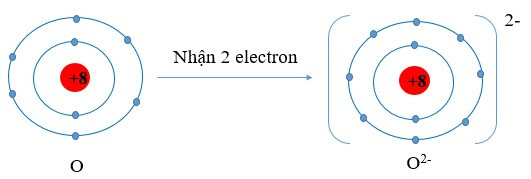
Viết gọn: O + 2e → O2-
Chú ý: Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tưr nhường hoặc nhận.
2. Liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
- Ví dụ: Sự hình thành liên kết ion trong phân từ sodium chloride:
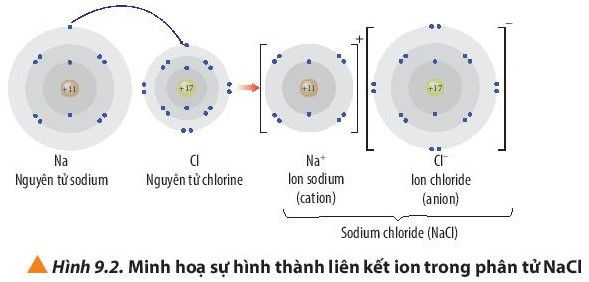
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
Phương trình hóa học: 2Na + Cl2 → 2NaCl.
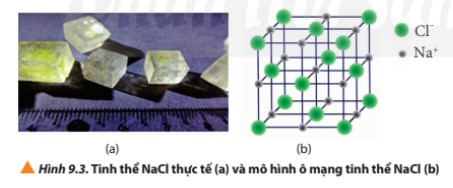
II. Tinh thể ion
- Tinh thể ion là hợp chất ion ở dạng rắn. Chúng gồm các ion liên kết với nhau bằng lực hút tĩnh điện tạo thành một mạng tinh thể.
- Ô mạng tinh thể là đơn vị nhỏ nhất của mạng tinh thể, hiển thị cấu trúc không gian ba chiều của toàn bộ tinh thể.
- Tinh thể của một chất có thể xem là một ô mạng lặp đi lặp lại trong không gian ba chiều.
- Do các hợp chất ion có cấu trúc tinh thể nên trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện.
Ví dụ: NaCl là hợp chất ion phổ biến. Trong điều kiện thường, hợp chất này tồn tại dưới dạng tinh thể rắn, cứng, dễ tan trong nước và có nhiệt độ nóng chảy cao.
Lý thuyết Liên kết ion (Chân trời sáng tạo) hay, chi tiết | Hóa học 10
20 câu Trắc nghiệm Liên kết ion (Chân trời sáng tạo) có đáp án – Hóa học lớp 10
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
Liên kết ion trong hợp chất KF được tạo bởi lực hút tĩnh điện giữa
Cho các hợp chất sau: NH3, MgO, HCl, K2SO4, H2O. Số hợp chất mà phân tử chứa liên kết ion là?