Tailieumoi.vn xin giới thiệu phương trình Zn + NaOH + H2O → Na2[Zn(OH)4] + H2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Đồng . Mời các bạn đón xem:
Phương trình Zn + NaOH + H2O → Na2[Zn(OH)4] + H2
1. Phương trình phản ứng Zn tác dụng NaOH
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Bản chất của Zn (Kẽm) trong phản ứng
Zn tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
4. Tính chất hoá học
4.1. Tính chất hóa học của Zn
Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
a.Tác dụng với phi kim
Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
b. Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4 loãng:
Zn + 2HCl → ZnCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
c.Tác dụng với H2O
Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
d. Tác dụng với bazơ
Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
4.2. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
- Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
- Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
- Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
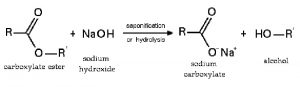
- Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
- Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
- Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
5. Bài tập vận dụng liên quan
Câu 1. Oxit nào dưới đây phản ứng được với HCl lẫn NaOH.
A. CaO
B. FeO
C. ZnO
D. MgO
Lời giải:
Câu 2. Cho dung dịch chứa FeCl2 và ZnCl2 tác dụng với dung dịch KOH dư, sau đó lấy kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn gồm:
A. Fe2O3, ZnO
B. FeO
C. Fe3O4, ZnO
D. Fe2O3
Lời giải:
FeCl2 + 2KaOH → Fe(OH)2 + 2KCl
ZnCl2 + 4KOH dư → K2ZnO2 + 2KCl + 2H2O
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Fe(OH)3 → Fe2O3 + H2O
Vậy chất rắn sau phản ứng là Fe2O3
Câu 3. Ngâm một lá Zn vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch X thì thấy bọt khí thoát ra rất nhiều và nhanh. Chất tan trong dung dịch X là
A. H2SO4.
B. FeSO4.
C. KOH.
D. Al2(SO4)3
Lời giải:
Chất tan trong X là FeSO4 vì khi nhỏ FeSO4 vào xảy ra phản ứng:
Zn + FeSO4 → ZnSO4 + Fe
Fe bám vào lá Zn tạo thành cặp điện cực Zn - Fe cùng nhúng trong dung dịch điện li nên có xảy ra sự ăn mòn điện hóa nên khiến cho bọt khí thoát ra nhiều và nhanh hơn.