Câu hỏi và bài tập (trang 48 SGK Hóa Học 12)
Bài 1 trang 48 SGK Hóa Học 11: Ứng với công thức phân tử C4H9NO2 có bao nhiêu amino axit đồng phân cấu tạo của nhau ?
A. 3;
B. 4;
C. 5;
D. 6.
Lời giải:

Đáp án C
Bài 2 trang 48 SGK Hóa Học 11: Có ba chất hữu cơ: H2NCH2COOH, CH3CH2COOH và CH3[CH2]3NH2.
Để nhận ra dung dịch của các hợp chất trên, chỉ cẩn dùng thuốc thử nào sau đây ?
A. NaOH;
B. HCl;
C. CH3OH/HCl;
D. Quỳ tím
Amino axit có số nhóm -NH2 bằng với số nhóm -COOH không làm đổi màu quỳ tím
- Amin làm quỳ tím hóa xanh
- Axit cacboxylic làm quỳ tím hóa đỏ (hồng)
Lời giải:
Đáp án D
Cho quỳ tím vào 3 mẫu thử, mẫu thử nào quỳ tím có màu đỏ là ![]() , mẫu thử nào quỳ tím có màu xanh là
, mẫu thử nào quỳ tím có màu xanh là ![]() , mẫu thử mà quỳ tím không màu là
, mẫu thử mà quỳ tím không màu là ![]()
Bài 3 trang 48 SGK Hóa Học 11: α-Amino axit X có phần trăm khối lượng các nguyên tố C, H, N lần lượt bằng 40,45%, 7,86%, 15,73%, còn lại là oxi và có công thức phân tử trùng với công thức đơn giản nhất. Xác định công thức cấu tạo và gọi tên của X.
Phương pháp giải:
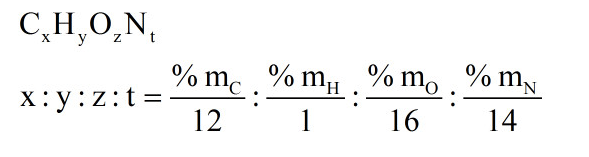
Gọi CTPT của X là CxHyOzNt
%mO = 100% - (%mC + %mH + %mN) = 35,96%
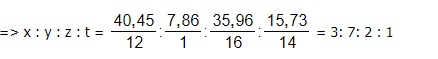
CTĐG của X là C3H7O2 N
Vì công thức phân tử của X trùng với công thức đơn giản nhất
=> CTPT: C3H7O2N
CTCT: H2N-CH(CH3)-COOH (Alanin)
Bài 4 trang 48 SGK Hóa Học 11: Viết phương trình hóa học của các phản ứng giữa axit 2-aminopropanoic với:
NaOH; H2SO4; CH3OH có mặt khí HCl bão hòa.
Lời giải:
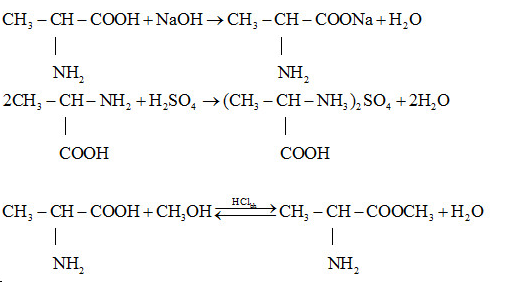
Bài 5 trang 48 SGK Hóa Học 11: Viết phương trình hóa học của phản ứng trùng ngưng các amino axit sau:
a) Axit 7-aminoheptanoic;
b) Axit 10-aminođecanoic.
Lời giải:
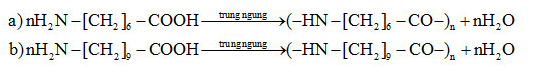
Bài 6 trang 48 SGK Hóa Học 11: Este A được điều chế từ amino axit B (chỉ chứa C, H, N, O) và ancol metylic. Tỉ khối hơi của A so với H2 là 44,5. Đốt cháy hoàn toàn 8,9 gam este A thu được 13,2 gam CO2, 6,3 gam H2O và 1,12 lít N2 (đo ở đktc).
Xác định công thức, viết công thức cấu tạo của A và B.
Phương pháp giải:
BTNT:
nC=nCO2
nH=2nH2O
nN=2nN2
mO=meste-mC-mH-mN => nO
=> C:H:O:N => CTĐGN
=> CTPT A(dựa vào tỉ khối của este với H2)
=> CTCT của A, B
Lời giải:
MA = 44,5 . 2 = 89 (g/mol);
nCO2=13,2/44=0,3 mol;
nH2O=6,3/18=0,35 mol;
nN2=1,12/22,4=0,05 mol
nC=nCO2=13,2/44=0,3 mol
nH=2nH2O=0,7 mol
nN=2nN2=0,1 mol
mO=meste-mC-mH-mN
= 8,9-0,3.12-0,7.1-0,1.14=3,2 gam
=> nO=3,2/16=0,2 mol
=> C:H:O:N = 0,3:0,7:0,2:0,1 = 3:7:2:1
=> CTĐGN: C3H7O2N
Mà MA = 89 => CTPT: C3H7O2N
Vì A là este của ancol metylic
=> CTCT: H2N-CH2-COOCH3 (A); H2N-CH2-COOH (B)
Lý thuyết bài 10: Amino axitI. KHÁI NIỆM, CẤU TẠO
1. Khái niệm
Amino axit là hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm amino ( NH2 ) và nhóm cacboxyl ( COOH).
Ví dụ: H2N – CH2 – COOH
2. Cấu tạo phân tử
Ở trạng thái kết tinh, amino axit tồn tại dưới dạng ion lưỡng cực. Trong dung dịch, dạng ion lưỡng cực, chuyển một phần nhỏ thành dạng phân tử
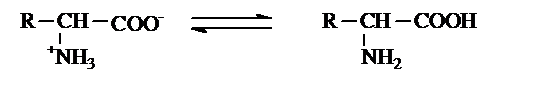
dạng ion lưỡng cực dạng phân tử-
II. DANH PHÁP
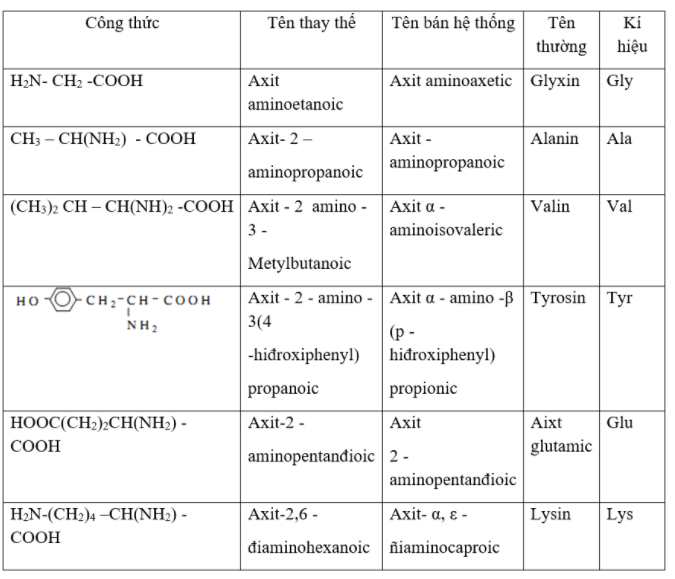
- Danh pháp thay thế: axit + vị trí + amino + tên axit cacboxylic tương ứng.
Ví dụ: H2N–CH2–COOH: axit aminoetanoic
HOOC–[CH2]2–CH(NH2)–COOH: axit 2-aminopentanđioic
- Tên bán hệ thống: axit + vị trí chữ cái Hi Lạp (α, β, γ, δ, ε, ω) + amino + tên thông thường của axit cacboxylic tương ứng.
Ví dụ: CH3–CH(NH2)–COOH: axit α-aminopropionic
H2N–[CH2]5–COOH: axit ε-aminocaproic
H2N –[ CH2]6–COOH: axit ω-aminoenantoic
- Tên thông thường: các amino axit thiên nhiên (α-amino axit) đều có tên thường.
III. TÍNH CHẤT VẬT LÍ
Các amino axit là các chất rắn không màu, vị hơi ngọt, dễ tan trong nước vì chúng tồn tại ở dạng ion lưỡng cực (muối nội phân tử), nhiệt độ nóng chảy cao (vì là hợp chất ion)
IV. TÍNH CHẤT HÓA HỌC
1. Tác dụng lên thuốc thử màu: (H2N)x – R – (COOH)y. Khi:
- x = y thì amino axit trung tính, quỳ tím không đổi màu
- x > y thì amino axit có tính bazơ, quỳ tím hóa xanh
- x < y thì amino axit có tính axit, quỳ tím hóa đỏ
2. Tính chất axit – bazơ của dung dịch amino axit
Thể hiện tính chất lưỡng tính
- Tác dụng với dung dịch bazơ (do có nhóm COOH)
H2N–CH2–COOH + NaOH → H2N–CH2–COONa + H2O
- Tác dụng với dung dịch axit (do có nhóm NH2)
H2N–CH2–COOH + HCl → ClH3N–CH2–COOH
3. Phản ứng este hóa nhóm COOH
Tương tự như axit cacboxylic, amino axit cũng có phản ứng với ancol (xt: H+) tạo este
![]()
4. Phản ứng của nhóm NH2 với HNO2
H2N–CH2–COOH + HNO2 → HO–CH2–COOH + N2 + H2O axit hiđroxiaxetic
5. Phản ứng trùng ngưng
Phản ứng trùng ngưng của ε và ω-amino axit tạo polime thuộc loại poliamit
nH2N – [CH2]5-COOH ![]() -(NH – [CH2]5 – CO)-n + nH2O
-(NH – [CH2]5 – CO)-n + nH2O
Axit - aminocaproic policaproamit
V. ỨNG DỤNG
- Là những hợp chất cơ sở kiến tạo nên các protein của cơ thể sống
- Được dùng phổ biến trong đời sống: dùng làm gia vị thức ăn, thuốc hỗ trợ thần kinh, thuốc bổ gan,...
- Dùng trong CN: sản xuất tơ nilon,...
Phương pháp giải một số dạng về Amino axit
Dạng 1: Lý thuyết về amino axit
* Một số ví dụ điển hình
Ví dụ 1: Amino axit là hợp chất hữu cơ trong phân tử
A. chứa nhóm cacboxyl và nhóm amino.
B. chỉ chứa nhóm amino.
C. chỉ chứa nhóm cacboxyl.
D. chỉ chứa nitơ hoặc cacbon.
Hướng dẫn giải chi tiết:
Amino axit là hợp chất hữu cơ trong phân tử chứa nhóm cacboxyl và nhóm amino.
Đáp án A.
Ví dụ 2: : Ở điều kiện thường, các amino axit
A. đều là chất khí.
B. đều là chất lỏng.
C. đều là chất rắn.
D. có thể là rắn, lỏng hoặc khí.
Hướng dẫn giải chi tiết:
Amino axit là hợp chất tồn tại ở dạng lưỡng cực : NH3+-R-COO-
=> Ở điều kiện thường, các amino axit đều là chất rắn.
Đáp án C.
Ví dụ 3: pH của dung dịch cùng nồng độ mol của 3 chất H2NCH2COOH, CH3CH2COOH và CH3(CH2)3NH2 tăng theo trật tự nào sau đây ?
A. CH3(CH2)3NH2 < H2NCH2COOH < CH3CH2COOH.
B. CH3CH2COOH < H2NCH2COOH < CH3(CH2)3NH2.
C. H2NCH2COOH < CH3CH2COOH < CH3(CH2)3NH2.
D. H2NCH2COOH < CH3(CH2)3NH2 < CH3CH2COOH.
Hướng dẫn giải chi tiết:
CH3CH2COOH có môi trường axit
NH2CH2COOH có môi trường trung tính
CH3(CH2)3NH2 có môi trường bazo
=> Vậy pH của 3 chất trên được sắp sếp như sau:
CH3CH2COOH < H2NCH2COOH < CH3(CH2)3NH2.
Đáp án B.
Ví dụ 4: : Cho các dãy chuyển hóa : ![]() . Vậy X2 là :
. Vậy X2 là :
A. H2NCH2COOH.
B. H2NCH2COONa.
C. ClH3NCH2COOH.
D. ClH3NCH2COONa
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
H2NCH2COOH + NaOH → H2NCH2COONa + H2O
H2NCH2COONa + 2HCl → ClH3NCH2COOH + NaCl
Đáp án C
Dạng 2: Bài toán về tính lưỡng tính của amino axit
* Một số lưu ý cần nhớ:
- Amino axit có chứa cả -COOH mang tính axit và –NH2 mang tính bazo nên amino axit có tính lưỡng tính
* Nếu amino axit tác dụng với axit
m Muối = m Amino axit + m Axit
* Nếu amino axit tác dụng với dung dịch kiềm:
m Muối = m Amino axit + m Dung dịch kiềm – m H2O
* Một số ví dụ điển hình:
Ví dụ 1: Cho hỗn hợp 2 aminoaxit no chứa 1 chức axit và 1 chức amino tác dụng với 110 ml dung dịch HCl 2M được dung dịch X. Để tác dụng hết với các chất trong X, cần dùng 140 ml dung dịch KOH 3M. Tổng số mol 2 aminoaxit là :
A. 0,1.
B. 0,2.
C. 0,3.
D. 0.4.
Hướng dẫn giải chi tiết:
2 amin trên có dạng NH2-R-COOH
Ta có sơ đồ quá trình phản ứng như sau:
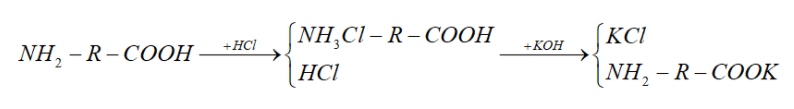
n HCl = 0,1 * 2 = 0,22 mol
n KOH = 0,14 * 3 = 0,42 mol
Áp dụng định luật bảo toàn nguyên tố Clo
=> n HCl = nKCl = 0,22 (mol)
Áp dụng định luật bảo toàn nguyên tố K
=> n KOH = n KCl + n NH2-R-COOK
=> n NH2-R-COOK = 0,42 – 0,22 = 0,2 (mol)
=> n Amino axit = n NH2-R-COOK = 0,2 (mol)
Đáp án B.
Ví dụ 2: Hợp chất X là một a-amino axit. Cho 0,01 mol X tác dụng vừa đủ với 80 ml dung dịch HCl 0,125M, sau đó đem cô cạn dung dịch thu được 1,835 gam muối. Phân tử khối của X là :
A. 174.
B. 147.
C. 197.
D. 187.
Hướng dẫn giải chi tiết:
n HCl = 0,08 * 0,125 = 0,01 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
m X + m HCl = m Muối
=> m X = 1,835 – 0,01 * 36,5 = 1,47 (gam)
Khối lượng mol của X là:
1,47 : 0,01 = 147 (gam/mol)
Đáp án B.
Dạng 3: Phản ứng đốt cháy amino axit
* Một ví dụ điển hình:
Ví dụ 1: Khi đốt cháy hoàn toàn một amino axit X là đồng đẳng của axit aminoaxetic, thu được . Công thức cấu tạo thu gọn có thể có của X là :
A. CH3CH(NH2)COOH, H2NCH2CH2COOH.
B. H2N[CH2]3COOH, CH3CH(NH2)CH2COOH.
C. H2N[CH2]4COOH, H2NCH(NH2)[CH2]2COOH.
D. Kết quả khác.
Hướng dẫn giải chi tiết:
X là đồng đẳng của axit amino axetic
=> X là amino axit no, đơn chức mạch hở
CTPT của X có dạng: CnH2n+1NO2
Ta có phương trình đốt cháy:
CnH2n+1NO2 + O2 → n CO2 + (2n+1)/2 H2O + N2
Vì tỉ lệ về thể tích cũng chính là tỉ lệ về số mol
=> V CO2 / V H2O = n : ![]() = 6 : 7
= 6 : 7
=> n = 3
=> CTPT của X là: C3H7NO2
CTCT của X có thể có là: CH3CH(NH2)COOH, H2NCH2CH2COOH.
Đáp án A
Ví dụ 2: : Đốt cháy 8,7 gam amino axit X thì thu được 0,3 mol CO2 ; 0,25 mol H2O và 0,05 mol N2 (đktc). CTPT của X là :
A. C3H7O2N.
B. C3H5O2N.
C. C3H7O2N2
D. C3H9O2N2.
Hướng dẫn giải chi tiết:
Áp dụng định luật bảo toàn nguyên tố ta có:
n C = n CO2 = 0,3 mol
n H = 2 n H2O = 0,25 .2 = 0,5 mol
n N = 2 n N2 = 0,05 .2 = 0,1 mol
m O = m X – m C – m H – m O
= 8,7 – 0,3 .12 – 0,5 . 1 – 0,1 . 14 = 3,2 gam
=> n O = 3,2 : 16 = 0,2 mol
Ta có: n C : n H : n N : n O
= 0,3 : 0,5 : 0,1 : 0,2 = 3 : 5 : 1 : 2
=> CTPT của X là : C3H5NO2
Đáp án B