Tailieumoi.vn giới thiệu Giải bài tập hóa học 8 Bài 17: Bài luyện tập 3, chi tiết nhất giúp học sinh dễ dàng làm bài tập Bài luyện tập 3 lớp 8.
Giải bài tập Hóa học lớp 8 Bài 17: Bài luyện tập 3
Câu hỏi và bài tập (trang 60, 61 sgk Hóa học lớp 8)
a) Tên các chất tham gia và sản phẩm của phản ứng.
b) Liên kết giữa các nguyên tử thay đổi như thế nào ? Phân tử nào biến đổi, phân tử nào được tạo ra ?
c) Số nguyên tử mỗi nguyên tố trước và sau phản ứng bằng bao nhiêu, có giữ nguyên không ?
Chú thích
Về điều kiện cho phản ứng xảy ra hãy xem trong bài đọc thêm sau bài 13, trang 51. Để nhận biết có chất mới là amoniac ta thử một tính chất của amoniac mà các em đã có dịp biết trong thí nghiệm 1, bài 7. Bài thực hành 2, trang 28.
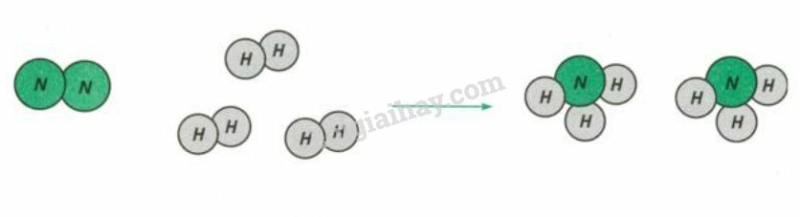
a) Chất tham gia: nitơ N2, hiđro H2
Sản phẩm: amoniac NH3
b) Trước phản ứng, hai nguyên tử hiđro liên kết với nhau. Sau phản ứng, ba nguyên tử hiđro liên kết với một nguyên tử nitơ. Phân tử hiđro và phân tử nitơ biến đổi, phân tử amoniac được tạo ra.
c) Số nguyên tử nguyên tố N trước và sau phản ứng đều là 2. Số nguyên tử nguyên tố H trước và sau phản ứng đều bằng 6.
Như vậy, số nguyên tử mỗi nguyên tố trước và sau phản ứng không thay đổi.
Hãy chọn phương án đúng trong số các phương án sau :
A. Ý 1 đúng, ý 2 sai ;
B. Ý 1 sai, ý 2 đúng ;
C. Cả hai ý đều đúng, nhưng ý 1 không giải thích cho ý 2 ;
D. Cả hai ý đều đúng và ý 1 giải thích cho ý 2 ;
E. Cả hai ý đều sai.
(Ghi trong vở bài tập).
Lời giải:
Cả hai ý đều đúng và ý 1 giải thích cho ý 2 ;
Đáp án D
Canxi cacbonat → Canxi oxit + Cacbon đioxit
Biết rằng khi nung 280 kg đá vôi tạo ra 140 kg canxi oxit CaO (vôi sống) và 110 kg khí cacbon đioxit CO2.
a) Viết công thức về khối lượng của các chất trong phản ứng.
b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi.
Lời giải:
a) Phương trình hóa học:
CaCO3 CaO + CO2
Theo định luật bảo toàn khối lượng, ta có:
b)
Phần trăm khối lượng của canxi cacbonat chứa trong đá vôi là:
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ giữa số phân tử etilen lần lượt với số phân tử oxi và số phân tử cacbon đioxit.
(*) Etilen là một hợp chất hữu cơ. Về hóa trị của cacbon trong hợp chất này sẽ đề cập ở chương 4 sách giáo khoa lớp 9.
Lời giải:a) Phương trình hóa học phản ứng:
C2H4 + 3O2 2CO2 + 2H2O
b) Tỉ lệ giữa số phân tử etilen lần lượt với số phân tử oxi và số phần tử cacbon đioxit
+ Phân tử etilen : phân tử oxi là 1:3
+ Phân tử etilen : phân tử cacbonđioxit là 1:2
Al + CuSO4 ---> Alx(SO4)y + Cu
a) Xác định các chỉ số x và y.
b) Lập phương trình hóa học. Cho biết tỉ lệ số nguyên tử của cặp đơn chất kim loại và số phân tử của cặp hợp chất.
Lời giải:
a)
b) Phương trình hóa học:
2Al + 3CuSO4 -> Al2(SO4)3 + 3Cu
- Tỉ lệ: dựa vào hệ số cân bằng ở phương trình, ta thấy được
Số nguyên tử nhôm Al : Số nguyên tử đồng Cu = 2 : 3
Số phân tử đồng sunfat CuSO4 : Số phân tử nhôm sunfat Al2(SO4)3 = 3 : 1
1. Hiện tượng hóa học: Sự biến đổi từ chất này thành chất khác được gọi là hiện tượng hóa học. Quá trình biến đổi chất như thế được gọi là phản ứng hóa học.
Trong phản ứng hóa học chỉ diễn ra sự thay đổi liên kết giữa các nguyên tử làm cho phân tử biến đổi, kết quả là chất biến đổi. Còn số nguyên tử mỗi nguyên tố giữ nguyên trước và sau phản ứng.
Dựa vào định luật bảo toàn khối lượng tính được khối lượng của một chất khi biết khối lượng của các chất khác nhau trong phản ứng.
2. Phương trình hóa học: gồm những công thức hóa học của các chất trong phản ứng với hệ số thích hợp sao cho số nguyên tử mỗi nguyên tố ở hai bên đều bằng nhau.
Để lập phương trình hóa học, ta phải cân bằng hệ số nguyên tử của mỗi nguyên tố (và nhóm nguyên tử, nếu có).