Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 8 Bài 17: Luyện tập chương II chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 8. Mời các bạn đón xem:
Giải SBT Hóa học 8 Bài 17: Luyện tập chương II
Bài 17.1 trang 23 SBT Hóa học 8: Hình dưới đây là sơ đồ tượng trưng cho phản ứng giữa khí hiđro H2 và chất đồng(II) oxit CuO tạo ra kim loại đồng và nước.
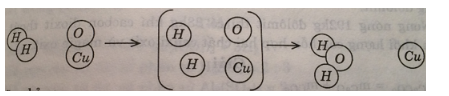
Hãy chỉ ra :
a) Mỗi phản ứng xảy ra với bao nhiêu phân tử của mỗi chất phản ứng, tạo ra bao nhiêu phân tử nước và nguyên tử đồng.
b) Liên kết giữa những nguyên tử trong phân tử nào bị tách rời, trong phân tử nào mới được tạo ra.
Lời giải:
a) Mỗi phản ứng xảy ra với một phân tử H2 và một phân tử CuO, tạo ra một phân tử nước và một nguyên tử đồng.
b) Liên kết giữa những nguyên tử trong phân tử H2 và trong phân tử CuO bị tách rời.
Liên kết giữa những nguyên tử trong phân tử nước mới được tạo ra.
Bài 17.2 trang 23 SBT Hóa học 8: Trong một phản ứng hoá học, các chất phản ứng và các sản phẩm phải chứa cùng :
A. Số nguyên tử trong mỗi chất.
B. Số nguyên tử của mỗi nguyên tố.
C. Số phân tử của mỗi chất.
Phương pháp giải:
Trong phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác => Số nguyên tử trước và sau phản ứng không thay đổi.
Lời giải:
Trong một phản ứng hoá học, các chất phản ứng và các sản phẩm phải chứa cùng số nguyên tử của mỗi nguyên tố.
=> Chọn B
Bài 17.3 trang 23 SBT Hóa học 8: Dây tóc trong bóng đèn điện nóng đỏ và phát sáng mỗi khi có dòng điện đi qua. Trường hợp bóng đèn bị rạn nứt và không khí (có khí oxi) chui vào bên trong thì dây tóc bị cháy khi bật công tắc điện. (Xem lại bài tập 2.2 về dây tóc trong bóng đèn điện.)
Hãy phân tích và chỉ ra khi nào xảy ra hiện tượng vật lí, khi nào xảy ra hiện tượng hoá học.
Lời giải:
Mỗi khi có dòng điện đi qua, kim loại vonfram (dây tóc bóng đèn điện) nóng đỏ và phát sáng, sau khi ngắt điện (không có dòng điện) kim loại vonfram lại trở về như cũ. Do tác dụng của dòng điện làm cho kim loại vonfram nóng đỏ và phát sáng, đó là hiện tượng vật lí.
Kim loại vonfram bị cháy khi có dòng điện đi qua (bật công tắc điện) là do kim loại nóng lên lại có khí oxi (trong không khí chui vào) nên phản ứng với chất này (tương tự kim loại magie, xem bài tập 3, thuộc bài 15, SGK) và biến đổi thành chất khác, đó là hiện tượng hoá học.
Bài 17.4 trang 23 SBT Hóa học 8: Đá đôlômit là hỗn hợp hai chất canxi cacbonat CaCO3 và magie cacbonat MgCO3. Khi nung nóng, tương tự canxi cacbonat, chất magie cacbonat cũng bị phân huỷ tạo ra chất magie oxit MgO và khí cacbon đioxit.
a) Viết công thức về khối lượng của hai phản ứng xảy ra khi nung nóng đôlômit.
b) Nung nóng 192 kg đôlômit thì có 88 kg khí cacbon đioxit thoát ra. Tính khối lượng của hỗn hợp hai chất canxi oxit và magie oxit.
Phương pháp giải:
a) Áp dụng định luật bảo toàn khối lượng.
b) Trong một phản ứng có n chất, nếu biết khối lượng của (n – 1) chất thì tính được khối lượng của chất còn lại.
Lời giải:
PTHH:
a)
b) Khối lượng của hỗn hợp ( ) hai chất canxi oxit và magie oxit bằng :
(kg)
Bài 17.5 trang 23 SBT Hóa học 8: Cho sơ đồ của các phản ứng sau :
a) K + O2 -----> K2O
b) Al + CuCl2 -----> AlCl3 + Cu
c) NaOH + Fe2(SO4)3 -------> Fe(OH)3 + Na2SO4
Lập phương trình hoá học của mỗi phản ứng và cho biết tỉ lệ số nguyên tử, số phân tử của hai cặp chất trong phản ứng (tuỳ chọn).
Phương pháp giải:
Bước 1. Cần viết đúng các công thức hoá học. Đến bước sau không thay đổi chỉ số trong những công thức đã viết đúng.
Bước 2. Nhẩm tính số nguyên tử của tất cả các nguyên tố
Nếu có nguyên tố mà số nguyên tử một bên lẻ, một bên chẵn thì trước hết ta làm chẵn số nguyên tử lẻ (đặt hệ số 2).
Để cân bằng số nguyên tử ta lấy bội số chung nhỏ nhất chia cho các số nguyên tử không bằng nhau của một nguyên tố thì được hệ số cho công thức của các chất tương ứng. Nên bắt đầu từ nguyên tố mà số nguyên tử có nhiều nhất, rồi tiếp đến nguyên tố có số nguyên tử ít hơn...
Thí dụ, sơ đồ của phản ứng :
Làm chẵn số nguyên tử O ở bên phải
Bắt đầu cân bằng từ nguyên tố O, bội số chung nhỏ nhất của 6 và 2 là 6.
Hệ số của O2 sẽ là 3 (= 6: 2)
Tiếp theo là nguyên tố Cr
Lưu ý :
- Nếu có nhóm nguyên tử thì coi cả nhóm như một đơn vị để cân bằng.
- Có trường hợp sơ đồ của phản ứng đã là phương trình hoá học rồi, thí dụ :
CaCO3 ----- > CaO + CO2
Viết liền mũi tên rời là được phương trình hoá học.
- Có trường hợp chỉ cần nhận xét thành phần hoá học các hợp chất là rút ra được các hệ số thích hợp.
Thí dụ, sơ đồ của phản ứng giữa khí cạcbon oxit và chất sắt (III) oxit.
CO + Fe2O3 —> Fe + CO2
Nhận xét : Mỗi phân tử CO chiếm một O của Fe2O3 chuyển thành phân tử CO2. Như vậy cần 3CO để chiếm hết oxi của Fe2O3. Phương trình hoá học của phản ứng : 3CO + Fe2O3 —> 2Fe + 3CO2
Lời giải:
a) 4K + O2 2K2O
Cứ 4 nguyên tử K tác dụng với 1 phân tử O2 ;
Cứ 1 phân tử O2 phản ứng tạo ra 2 phân tử K2O.
b) 2Al + 3CuCl2 2AlCl3 + 3Cu
Cứ 2 nguyên tử Al tác dụng với 3 phân tử CuCl2.
Cứ 2 nguyên tử Al phản ứng tạo ra 3 nguyên tử Cu.
c) 6NaOH + Fe2(SO4)3 2Fe(OH)3 + 3Na2SO4
Cứ 6 phân tử NaOH tác dụng với 1 phân tử Fe2(SO4)3 ;
Cứ 6 phân tử NaOH phản ứng tạo ra 2 phân tử Fe(OH)3 ;
hay cứ 3 phân tử NaOH phản ứng tạo ra 1 phân tử Fe(OH)3.
Bài 17.6 trang 24 SBT Hóa học 8: Biết rằng khí axetilen (khí đất đèn) C2H2 cháy là xảy ra phản ứng với khí oxi O2 , sinh ra khí cacbon đioxit CO2 và nước.
a) Lập phương trình hoá học của phản ứng.
b) Cho biết tỉ lệ giữa số phân tử axetilen lần lượt với số phân tử khí cacbon đioxit và số phân tử nước.
Lời giải:
a) 2C2H2 + 5O2 4CO2 + 2H2O
b) Cứ 2 phân tử C2H2 tác dụng với 5 phân tử O2 ;
Cứ 2 phân tử C2H2 phản ứng tạo ra 4 phân tử CO2 ;
Cứ 1 phân tử C2H2 phản ứng tạo ra 1 phân tử H2O.
Bài 17.7 trang 24 SBT Hóa học 8: Biết rằng kim loại nhôm tác dụng với axit sunfuric H2SO4 tạo ra khí hiđro H2 và chất nhôm sunfat Al2(SO4)3.
a) Lập phương trình hoá học của phản ứng.
b) Cho biết tỉ lệ giữa số nguyên tử Al lần lượt với số phân tử của ba chất trong phản ứng.
Lời giải:
a) 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2↑
b) Cứ 2 nguyên tử Al tác dụng với 3 phân tử H2SO4 ;
Cứ 2 nguyên tử Al phản ứng tạo ra 1 phân tử Al2(SO4)3 ;
Cứ 2 nguyên tử Al phản ứng tạo ra 3 phân tử H2.
Bài 17.8 trang 24 SBT Hóa học 8: Hãy chọn hệ số và công thức hoá học thích hợp điền vào những chỗ có dấu hỏi trong các phương trình hoá học sau (chép vào vở bài tập).
CO2 + Ca(OH)2 -> CaCO3 + ?
? + ?AgNO3 -> Al(NO3)3 + 3Ag
? HCl + CaCO3 -> CaCl2 + H2O + ?
Phương pháp giải:
Cách cân bằng nhanh phương trình hóa học:
Bước 1. Cần viết đúng các công thức hoá học. Đến bước sau không thay đổi chỉ số trong những công thức đã viết đúng.
Bước 2. Nhẩm tính số nguyên tử của tất cả các nguyên tố
Nếu có nguyên tố mà số nguyên tử một bên lẻ, một bên chẵn thì trước hết ta làm chẵn số nguyên tử lẻ (đặt hệ số 2).
Để cân bằng số nguyên tử ta lấy bội số chung nhỏ nhất chia cho các số nguyên tử không bằng nhau của một nguyên tố thì được hệ số cho công thức của các chất tương ứng. Nên bắt đầu từ nguyên tố mà số nguyên tử có nhiều nhất, rồi tiếp đến nguyên tố có số nguyên tử ít hơn...
Thí dụ, sơ đồ của phản ứng :
Làm chẵn số nguyên tử O ở bên phải
Bắt đầu cân bằng từ nguyên tố O, bội số chung nhỏ nhất của 6 và 2 là 6.
Hệ số của O2 sẽ là 3 (= 6: 2)
Tiếp theo là nguyên tố Cr
Lưu ý :
- Nếu có nhóm nguyên tử thì coi cả nhóm như một đơn vị để cân bằng.
- Có trường hợp sơ đồ của phản ứng đã là phương trình hoá học rồi, thí dụ :
CaCO3 ----- > CaO + CO2
Viết liền mũi tên rời là được phương trình hoá học.
- Có trường hợp chỉ cần nhận xét thành phần hoá học các hợp chất là rút ra được các hệ số thích hợp.
Thí dụ, sơ đồ của phản ứng giữa khí cạcbon oxit và chất sắt (III) oxit.
CO + Fe2O3 —> Fe + CO2
Nhận xét : Mỗi phân tử CO chiếm một O của Fe2O3 chuyển thành phân tử CO2. Như vậy cần 3CO để chiếm hết oxi của Fe2O3. Phương trình hoá học của phản ứng : 3CO + Fe2O3 —> 2Fe + 3CO2
Lời giải:
a)
b)
c)
Bài 17.9 trang 24 SBT Hóa học 8: Cho sơ đồ của phản ứng sau :
Fe(OH)y + H2SO4 —> Fex(SO4)y + H2O
a) Hãy biện luận để thay x, y (biết rằng x ≠ y) bằng các chỉ số thích hợp rồi lập phương trình hoá học của phản ứng.
b) Cho biết tỉ lệ số phân tử của bốn cặp chất trong phản ứng (tuỳ chọn).
Phương pháp giải:
Fe có hoá trị II và III nên y bằng 2 hoặc 3
Mặt khác, nhóm (SO4) có hoá trị II => x, y
- Lập phương trình hóa học của phản ứng theo ba bước:
+ Viết sơ đồ phản ứng, gồm công thức hóa học của các chất tham gia sản phẩm.
+ Cân bằng số nguyên tử mỗi nguyên tố: tìm hệ số thích hợp đặt trước công thức.
+ Viết thành phương trình hóa học.
Lời giải:
a) Nguyên tố Fe có hoá trị II và III nên y bằng 2 hoặc 3
Nhóm (SO4) có hoá trị II nên x bằng 2
Cặp nghiệm x= 2 và y = 3 là phù hợp.
Sơ đồ của phản ứng :
Fe(OH)3 + H2SO4 —> Fe2(SO4)3 + H2O
Phương trình hoá học :
2Fe(OH)3 + 3H2SO4 -> Fe2(SO4)3 + 6H2O
b) Cứ 2 phân tử Fe(OH)3 tác dụng với 3 phân tử H2SO4 ;
Cứ 2 phân tử Fe(OH)3 phản ứng tạo ra 1 phân tử Fe2(SO4)3 ;
Cứ 3 phân tử H2SO4 phản ứng tạo ra 1 phân tử Fe2(SO4)3 ;
Cứ 1 phân tử Fe2(SO4)3 được tạo ra cùng với 6 phân tử H2O.
Bài 17.10 trang 24 SBT Hóa học 8: a) Biết rằng, khí hiđro dễ tác dụng với chất chì (IV) oxit PbO2, chiếm lấy oxi của chất này để tạo ra nước.
Viết phương trình hoá học của phản ứng và tên chất mới sinh ra.
b)Biết rằng, 3 g khí hiđro tác dụng vừa đủ với 179,25 g PbO2, tạo ra 27 g nước. Tính khối lượng chất mới sinh ra.
Phương pháp giải:
a)
b) Áp dụng định luật bảo toàn khối lượng:
Lời giải chi tiết
a) Phương trình hóa học của phản ứng:
kim loại chì là chất mới sinh ra.
b) Theo định luật bảo toàn khối lượng, khối lượng của chì bằng:
=3 + 179,25 - 27 = 155,25 (g)
Bài 17.11 trang 24 SBT Hóa học 8: Quặng malachit có thành phần chính là hai hợp chất của đồng được ghi bằng công thức chung là Cu2(OH)2CO3. Khi nung nóng thì hai hợp chất này bị phân huỷ, sản phẩm của phản ứng phân huỷ gồm có CuO, H2O và CO2.
a) Viết phương trình hoá học của phản ứng phân huỷ mỗi hợp chất của đồng.
b) Biết rằng khi nung nóng 4,8 kg quặng thì thu được 3,2 kg CuO cùng với 0,36 kg nước và 0,88 kg CO2. Tính tỉ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng.
Phương pháp giải:
a) Các phương trình hóa học của phản ứng phân hủy:
b) Áp dụng định luật bảo toàn khối lượng:
=>
Lời giải:
a) Công thức hóa học hai hợp chất của đồng:
Các phương trình hóa học của phản ứng phân hủy:
b) Theo định luật bảo toàn khối lượng, khới lượng hai hợp chất của đồng đã phân hủy bằng:
Tỷ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng bằng:
Bài 17.12* trang 25 SBT Hóa học 8: Để điều chế kali clorua KCl (dùng làm phân bón), người ta cho kim loại kali K tác dụng với khí clo Cl2.
a) Viết phương trình hoá học của phản ứng.
b) Nếu có 6,02.1023 nguyên tử K, cần lấy vào phản ứng bao nhiêu phân tử Cl2 và thu được bao nhiêu phân tử KCl ?
(Xem lại các bài tập 8.9*, 9.6* và 16.8* trước khi làm bài tập này và bài tập tiếp theo).
Lời giải:
a) Phương trình hóa học của phản ứng :
b) Theo phương trình hóa học, ta có tỷ lệ:
- Cứ 2 nguyên tử K tác dụng với phân tử Tạo ra 2 phân tử KCl.
Vậy nếu có nguyên tử cần lấy vào phản ứng:
(phân tử) Cl2.
và tạo ra : (phân tử) KCl
Bài 17.13* trang 25 SBT Hóa học 8: Những câu trong bài tập này coi là tiếp theo của bài tập 17.12*.
a) Tính khối lượng bằng gam của :
- 6,02.1023 nguyên tử K,
- 6,02.1023 phân tử CI2,
- 6,02.1023 phân tử KCl.
b) Tính khối lượng khí clo để tác dụng vừa đủ với 39 g kim loại kali.
c) Từ khối lượng kim loại cho biết và khối lượng khí clo tính được trong câu b), tính khối lượng kali clorua thu được theo hai cách.
Lời giải:
a) Khối lượng tính bằng gam của 6,02.1023 nguyên tử K (nguyên tử khối là 39 đvC) bằng :
- Khối lượng tính bằng gam của 6,02.1023 phân tử Cl2 (phân tử khối là :
2x35,5 = 71 đvC) bằng :
- Khối lượng tính bằng gam của 6,02.1023 phân tử KCl (phân tử khối là :
+ 35,5 = 74,5 đvC) bằng (đặt tính như trên) : 74,5 g.
b) 39 g kim loại kali là khối lượng của 6,02.1023 nguyên tử K. Số lượng nguyên tử K này tác dụng đủ với 3,01.1023 phân tử Cl2. Khối lượng của số
phân tử khí Cl2 này là
Cách 1 : Theo phương trình hoá học trong bài 17.12* thì 6,02.1023 nguyên tử K tác dụng với 3,01.1023 phân tử Cl2 tạo ra 6,02.1023 phân tử KCl. Vậy khối lượng KCl thu được là 74,5 g.
Cách 2 : Theo định luật bảo toàn khối lượng :
= 39 + 35,5 = 74,5 (g)