Tailieumoi.vn xin giới thiệu phương trình C3H4 + 2Br2 → C3H4Br4 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình C3H4 + 2Br2 → C3H4Br4
1. Phản ứng hóa học:
C3H4 + 2Br2 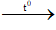
2. Điều kiện phản ứng
- Nhiệt độ
3. Cách thực hiện phản ứng
- Dẫn từ từ khí propin qua dung dịch nước brom (theo tỉ lệ 1:2).
4. Hiện tượng nhận biết phản ứng
- Ankin phản ứng làm mất màu dung dịch nước brom (phản ứng vừa đủ).
5. Tính chất hóa học
5.1. Tính chất hóa học của C3H4
a. Phản ứng cộng
- Cộng brom
- Dẫn propin qua dung dịch brom màu da cam.
+ Hiện tượng: Dung dịch brom bị mất màu.
+ Propin có phản ứng cộng với brom trong dung dịch.
+ Sản phẩm mới sinh ra có liên kết đôi trong phân tử nên có thể cộng tiếp với một phân tử brom nữa:
+ Trong điều kiện thích hợp, propin cũng có phản ứng cộng với hiđro và một số chất khác.
- Cộng hiđro
- Cộng hiđro clorua
+ Phản ứng cộng HX, H2O vào các ankin trong dãy đồng đẳng của axetilen cũng tuân theo quy tắc Mac-côp-nhi-côp như anken.
b. Phản ứng oxi hóa
- Propin là hiđrocacbon, vì vậy khi đốt, propin sẽ cháy tạo ra cacbon đioxit và nước, tương tự metan và etilen.
- Propin cháy trong không khí với ngọn lửa sáng, tỏa nhiều nhiệt.
c. Phản ứng thế bới kim loại
- Tính chất riêng của các ankin có nối ba đầu mạch
5.2. Tính chất hóa học của Br2
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
b. Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
6. Bạn có biết
- Phản ứng trên gọi là phản ứng cộng brom.
- Phản ứng xảy ra qua hai giai đoạn, Muốn dừng lại ở giai đoạn nào thì cần thực hiện phản ứng ở nhiệt độ thích hợp.
- Khối lượng dung dịch brom tăng bằng lượng ankin đã tham gia phản ứng.
7. Bài tập liên quan
Ví dụ 1: 4 gam một ankin X có thể làm mất màu tối đa 100 ml dd Br2 2M (phản ứng theo tỉ lệ 1:2). CTPT X là:
A. C5H8
B. C2H2
C. C3H4
D. C4H6
Hướng dẫn
CnH2n-2 + 2Br2 → CnH2n-2Br4
nBr2 = 2.0,1= 0,2 mol;
Theo pt: nCnH2n-2 = ½ . NBr2 = ½ .0,2 = 0,1 mol
MCnH2n-2 = 14n – 2 = 4/0,1 = 40
→ n = 3 → CTPT là: C3H4
Đáp án: C
Ví dụ 2: Ở nhiệt độ -20°C thì phản ứng với dung dịch nước brom của axetilen thu được sản phẩm là gì?
A. C3H4Br2
B. C3H4Br4
C. C2H4
D. Không phản ứng
Hướng dẫn
Ở -20°C thu được C3H4Br2
C3H4 + Br2 → C3H4Br2
Đáp án A
Ví dụ 3: Cho các chất sau đây: C3H6, C3H4, C3H8. Chất nào lmaf mất màu dung dịch brom?
A. C3H6
B. C3H4
C. C3H8
D. cả A,B
Hướng dẫn
Chất làm mất màu dung dịch brom là: C3H4, C3H6.
Đáp án D
8. Một số phương trình phản ứng hoá học khác của Ankin và hợp chất: