Tailieumoi.vn xin giới thiệu phương trình C2H4 + 3O2 → 2CO2 + 2H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình C2H4 + 3O2 → 2CO2 + 2H2O
1. Phản ứng hóa học:
C2H4 + 3O2 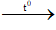
2. Điều kiện phản ứng
- Đốt cháy.
3. Cách thực hiện phản ứng
- Đốt cháy khí etilen trong không khí, sau phản ứng thu được khí CO2 và hơi nước.
4. Hiện tượng nhận biết phản ứng
- Sản phẩm sinh ra làm vần đục nước vôi trong.
5. Tính chất hóa học
5.1. Tính chất hóa học của C2H4
- Trong phân tử etilen, mỗi nguyên tử cacbon liên kết với hai nguyên tử hiđro, hai hóa trị còn lại dùng để liên kết hai nguyên tử cacbon với nhau.
- Công thức cấu tạo của etilen:
Viết gọn: CH2=CH2.
- Giữa hai nguyên tử cacbon có hai liên kết. Những liên kết như vậy được gọi là liên kết đôi.Trong liên kết đôi có một liên kết kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học.
a. Phản ứng cộng
- Phản ứng cộng halogen (phản ứng halogen hóa)
- Cộng brom
- Dẫn khí etilen qua dung dịch brom màu da cam
- Hiện tượng: Dung dịch brom bị mất màu.
- Nhận xét: Etilen đã phản ứng với brom trong dung dịch.
- Liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom. Phản ứng trên được gọi là phản ứng cộng.
- Ngoài brom, trong những điều kiện thích hợp, etilen còn có phản ứng cộng với một số chất khác. Ví dụ hiđro, clo.
- Nhìn chung, các chất có liên kết đôi (tương tự như etilen) dễ tham gia phản ứng cộng.
- Cộng clo
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
- Phản ứng cộng axit
- Hiđro halogenua (HCl, HBr, HI), axit sunfuric đậm đặc ,... có thể cộng vào etilen.
CH2=CH2 + HCl (khí ) → CH3CH2Cl : (etyl clorua)
CH2=CH2 + H-OSO3H → CH3CH2OSO3H : (etyl hiđrosunfat )
- Phản ứng cộng nước (phản ứng hiđrat hóa)
- Ở nhiệt độ thích hợp và có xúc tác axit, etilen có thể cộng nước.
b. Phản ứng trùng hợp
- Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác), liên kết kém bền trong phân tử etilen bị đứt ra. Khi đó, các phân tử etilen kết hợp với nhau tạo thành phân tử có kích thước và khối lượng rất lớn, gọi là polietilen (viết tắt là PE).
- Phản ứng trên được gọi là phản ứng trùng hợp.
- Polietilen là chất rắn, không tan trong nước, không độc. Nó là nguyên liệu quan trọng trong công nghiệp chất dẻo.
c. Phản ứng oxi hóa
- Etilen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C2H4 + 3O2 → 2CO2 + 2H2O
- Etilen làm mất màu dung dịch KMnO4:
2 CH2=CH2 + 2KMnO4 + 4H22O → + 2MnO2 + 2KOH (etylen glicol)
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
5.2. Tính chất hóa học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
a. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
b. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
c. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
6. Bạn có biết
- Phản ứng trên gọi là phản ứng oxi hóa hoàn toàn.
- Tương tự etilen, các anken khi bị đốt đều cháy và tỏa nhiều nhiệt.
- Khi đốt cháy anken, số mol H2O thu được sau phản ứng luôn bằng số mol CO2.
7. Bài tập liên quan
Ví dụ 1: Khi đốt cháy một anken thu được H2O và CO2 với tỷ lệ số mol là
A. > 1.
B. < 1.
C. = 1.
D. không xác định được.
Hướng dẫn:
Đáp án C.
Ví dụ 2: Nhận định nào sau đây là sai?
A. Các anken khi bị đốt đều cháy và tỏa nhiều nhiệt.
B. Đốt cháy anken, sau phản ứng thu được khí CO2 và hơi nước.
C. Khi đốt cháy anken, số mol H2O thu được sau phản ứng luôn bằng số mol CO2.
D. Khi đốt cháy hoàn toàn ankan, sản phẩm thu được làm mất màu dung dịch brom.
Hướng dẫn:
CO2, H2O không làm mất màu dung dịch brom.
Đáp án D.
Ví dụ 3: Đốt cháy 1 mol khí propilen trong không khí, sau phản ứng thu được khí CO2 và hơi nước có tổng số mol là
A. 2.
B. 4.
C. 6.
D. 8.
Hướng dẫn:
Đáp án C.
8. Một số phương trình phản ứng hóa học khác của Anken và hợp chất
3CH2=CH2 + 4H2O + 2KMnO4 → 3OH-CH2-CH2 – OH + 2MnO2 + 2KOH
CH2=CH–CH3 + Br2 → CH2Br–CHBr–CH3
CH2=CH–CH3 + Cl2 → CH2Cl–CHCl– CH3
CH2=CH–CH3 + HCl → CH3–CHCl–CH3
CH2=CH–CH3 + HBr → CH3-CHBr–CH3