Tailieumoi.vn xin giới thiệu phương trình Al(OH)3 + 3HBr → 3H2O + AlBr3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình Al(OH)3 + 3HBr → 3H2O + AlBr3
1. Phương trình phản ứng hóa học:
Al(OH)3 + 3HBr → 3H2O + AlBr3
2. Hiện tượng nhận biết phản ứng
- Nhôm hidroxit phản ứng với hidro bromua tạo thành nhôm bromua
3. Điều kiện phản ứng
- Nhiệt độ phòng
4. Tính chất hoá học
a. Tính chất hoá học của Al(OH)3
- Kém bền với nhiệt: Khi đun nóng Al(OH)3 phân hủy thành Al2O3.
2Al(OH)3 
- Là hiđroxit lưỡng tính:
Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO3 + 2H3O
Al(OH)3 + KOH → K[Al(OH)4]
b. Tính chất hoá học của HBr
- Dung dịch HBr trong nước được gọi là dung dịch axitbromhiđric. Axitbromhiđric là một axit mạnh, mạnh hơn axit clohiđric.
Tính khử:
HBr có tính khử mạnh hơn HCl, HBr khử được H2SO4 đặc thành SO2.
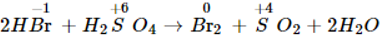
5. Cách thực hiện phản ứng
- Cho Al(OH)3 tác dụng với HBr
6. Bạn có biết
Các hidroxit phản ứng với axit tạo thành muối và nước
7. Bài tập liên quan
Ví dụ 1: Tại sao miếng Al (đã cạo sạch màng bảo vệ Al2O3) khử H2O rất chậm và khó, nhưng lại khử H2O dễ dàng trong dung dịch kiềm mạnh
A. Vì Al có tính khử kém hơn kim loại kiềm, kiềm thổ
B. Vì Al là kim loại có thể tác dụng với dung dịch kiềm
C. Vì Al tạo lớp màng bảo vệ Al(OH)3. Lớp màng bị tan trong dung dịch kiềm mạnh
D. Vì Al là kim loại có hiđrôxit lưỡng tính.
Đáp án: C
Hướng dẫn giải
Al phản ứng với nước tạo ra màng bảo vệ là Al(OH)3, nó ngăn không cho Al tiếp xúc với nước.
Trong dung dịch kiềm mạnh (NaOH, KOH…) màng bảo vệ Al(OH)3 sinh ra liền bị phá huỷ, do đó Al khử H2O dễ dàng, giải phóng khí H2.
Ví dụ 2: Cho dd NH3 dư vào dd AlCl3 và ZnCl2 thu được A. Nung A được chất rắn B. Cho luồng H2 đi qua B nung nóng sẽ thu được chất rắn:
A. Zn và Al
B. Zn và Al2O3
C. ZnO và Al2O3
D. Al2O3
Đáp án: D
Hướng dẫn giải
Cho NH3 dư vào thì kết tủa thu được chỉ có Al(OH)3, nung nóng X thì thu được Y sẽ là Al2O3. CO không có phản ứng với Al2O3 nên chất rắn thu được là Al2O3
Ví dụ 3: Trong các kim loại sau: Cu, Fe, Pb, Al người ta thường dùng kim loại nào để làm vật liệu dẫn điện hay dẫn nhiệt.
A. Chỉ có Cu
B. Cu và Al
C. Fe và Al
D. Chỉ có Al
Đáp án: B
Hướng dẫn giải
Đồng và nhôm được dùng làm vật liệu dẫn nhiệt
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al(OH)3 + H3PO4 → 3H2O + AlPO4↓
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4
Al2(SO4)3 + 6KOH → 2Al(OH)3↓ + 3K2SO4
Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3↓ + 3BaSO4↓
Al2(SO4)3 + 3Ca(OH)2 → 2Al(OH)3↓ + 3CaSO4↓
Al2(SO4)3 + 6H2O + 6NH3 → 3(NH4)2SO4 + 2Al(OH)3↓