Tailieumoi.vn biên soạn và giới thiệu các kiến thức lý thuyết trọng tâm bao gồm định nghĩa, tính chất, ứng dụng và
cách điều chế của C2H6 (etan) trong bài viết dưới đây, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn
thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
1. Định nghĩa về etan C2H6 là gì?
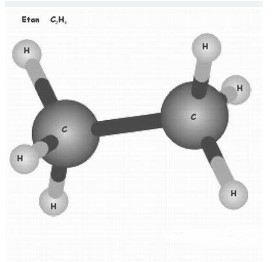
Khí etan (ethane) là một hợp chất hóa học, có công thức C2H6. Về bản chất nó là một ankan, được hiểu là một
hiđrocacbon no không mạch vòng.
2. Cách nhận biết Etan C2H6
- Nhận biết khí etan
+ Cách 1: Đốt cháy khí etan rồi cho sản phẩm vào dung dịch Ca(OH)2. Hiện tượng xuất hiện kết tủa vẩn đục
trắng, ta sẽ nhận biết được khí metan.
+ Cách 2: Cho khí etan tác dụng với clo dưới ánh sáng. Sau đó cho quỳ tím ẩm vào, quỳ hóa đỏ, ta sẽ nhận biết
được khí etan.

3. Tính chất lý hóa của etan C2H6
3.1. Tính chất vật lý của etan C2H6
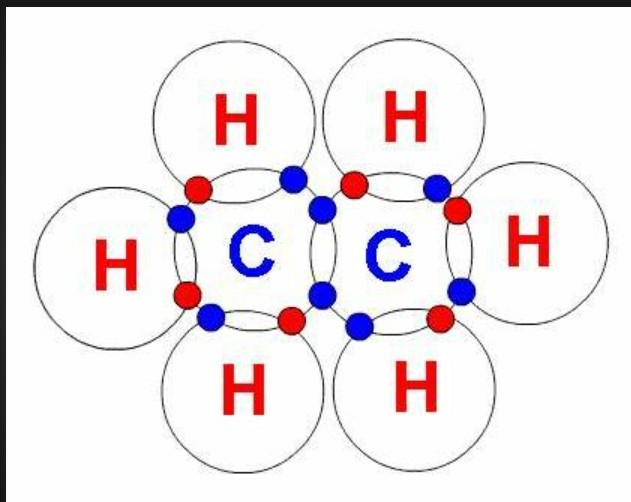
- Ở áp suất và nhiệt độ thường, etan là chất khí, không màu, không mùi. Nhẹ hơn nước, hầu như không tan trong
nước và tan nhiều trong hợp chất hữu cơ. Khi trộn vào nước thì bị tách thành lớp nổi lên trên, người ta nói chúng kị
nước.
- Nó có điểm sôi là -88,5 ºC và điểm nóng chảy là -182,8 ºC.
- Ngoài ra, nó không bị ảnh hưởng khi tiếp xúc với axit hoặc bazơ mạnh.
3.2. Tính chất hóa học của etan ra sao?
- Khi chiếu sáng hoặc đốt nóng hỗn hợp etan và clo sẽ xảy ra phản ứng thế lần lượt các nguyên tử hidro bằng
clo. Tương tự như metan.
C2H6 + Br2 → C2H5Br + HBr
- Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữu cơ có chứa halogen gọi là
dẫn xuất halogen.
CH2=CH2 + H2 → CH3 - CH3
Điều kiện phản ứng: 500oC, xt
- Khi đốt, etan bị cháy tạo ra CO2, H2O và tỏa nhiều nhiệt.
- Nếu không đủ oxi, ankan bị cháy không hoàn toàn, khi đó ngoài CO2 và H2O còn tạo ra các sản phẩm như CO,
than muội, không những làm giảm năng suất tỏa nhiệt mà còn gây độc hại cho môi trường.
4. Điều chế khí etan C2H6 như thế nào?
4.1. Trong công nghiệp
- Etan và các đồng đẳng được tách từ khí thiên nhiên và dầu mỏ.
4.2. Trong phòng thí nghiệm
5. Ứng dụng của etan C2H6

- Etan được ứng dụng làm nguyên liệu (Tách hidro C2H4..., halogen hóa CH2Cl2, CHCl3, CCl4...), làm nhiên liệu, vật
liệu: khí đốt, khí hóa lỏng.
- Etan là nguồn nguyên liệu thô trong công nghiệp hóa dầu, có thể chuyển hóa thành etylen nhờ phản ứng cracking.
6. Khí metan có gây nguy hiểm cho con người hay không?
- Ethane có khả năng bắt lửa, đặc biệt là khi nó liên kết với không khí. Với tỷ lệ phần trăm từ 3,0 đến 12,5% thể tích
ethane trong không khí, một hỗn hợp nổ có thể hình thành.
- Nó có thể hạn chế oxy trong không khí nơi nó được tìm thấy, và vì lý do này, nó thể hiện một yếu tố nguy cơ gây
ngạt thở cho người và động vật có mặt và tiếp xúc.
- Ethane ở dạng lỏng đông lạnh có thể làm bỏng da nghiêm trọng nếu tiếp xúc trực tiếp với nó, và cũng hoạt động
như một môi trường đông lạnh cho bất kỳ vật nào nó chạm vào, đóng băng trong giây lát.
- Hơi của ethane lỏng nặng hơn không khí và tập trung trên mặt đất, điều này có thể gây ra nguy cơ đánh lửa có thể
tạo ra phản ứng đốt cháy chuỗi.
- Việc uống ethane có thể gây buồn nôn, nôn và chảy máu trong. Hít phải, ngoài nghẹt thở, gây đau đầu, nhầm lẫn
và thay đổi tâm trạng. Tử vong do ngừng tim là có thể xảy ra ở mức phơi nhiễm cao.
- Nó đại diện cho một loại khí nhà kính, cùng với khí mê-tan và carbon dioxide, góp phần vào sự nóng lên toàn cầu
và biến đổi khí hậu do ô nhiễm của con người. May mắn thay, nó ít phong phú và bền hơn khí mê-tan và hấp thụ ít
bức xạ hơn thế này.
7. Một số bài tập liên quan đến C2H6

Bài tập 1: Nhận xét nào đúng khi nói về tính tan của etan trong nước?
A. Không tan
B. Tan ít
C. Tan nhiều
D. Không tan
Lời giải: Đáp án đúng là A
Bài tập 2: Tính thể tích khí oxy cần dùng và thể tích của khí cacbonic được tạo ra khi đốt cháy hoàn toàn 11,2 lít khí
C2H6 (đktc). Biết rằng thể tích các khí đều được đo ở đktc
Lời giải:
Ta có:
nC2H6 = 11,2/ 22,4 = 0,5 mol
PTPƯ:
2C2H6 + 7O2 → 4CO2 + 6H2O
Theo phương trình ta được:
nO2 = 7/2 x nC2H6 = 7/2 x 0.5 = 1.75 mol
nCO2 = 2 x nC2H6 = 1 mol
=> VO2 = 1.75 x 22,4 = 39.2l
=> VCO2 = 1 x 22,4 = 22.4l
Bài tập 3: Cho một hỗn hợp khí gồm khí CO2 và C2H6. Hãy trình bày phương pháp hóa học để có thể:
a) Thu được khí C2H6
b) Thu được khí CO2
Lời giải:
a) Tiến hành dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư, lúc này khí CO2 sẽ bị giữ lại bởi phản ứng tạo CaCO3,
khí bay ra khỏi dung dịch chính là khí C2H6 có lẫn hơi nước, sau khi dùng CaO làm khô ta thu được C2H6 tinh khiết
CO2 + Ca(OH)2 → CaCO3 + H2O
b) Lấy phần CaCO3 vừa thu được ở trên cho tác dụng với dung dịch HCl loãng, thu được khí CO2. Nếu muốn thu
CO2 tinh khiết chỉ cần làm lạnh ngưng tụ nước
CaCO3 + 2HCl → CaCl2 + H2O + CO2