Tailieumoi.vn xin giới thiệu phương trình 2Al + Fe2O3 → Al2O3 + 2Fe gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình 2Al + Fe2O3 → Al2O3 + 2Fe
1. Phương trình phản ứng hóa học:
2Al + Fe2O3 → Al2O3 + 2Fe
2. Hiện tượng nhận biết phản ứng
- Al2O3 kết tủa trắng, màu đỏ của Fe2O3 mất dần thành màu trắng xám của Fe.
3. Điều kiện phản ứng
- Điều kiện nhiệt độ cao.
4. Tính chất hoá học
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
5. Cách thực hiện phản ứng
- Nung Al và Fe2O3 ở điều kiện nhiệt độ cao.
6. Bạn có biết
Al có thể phản ứng với các oxit của kim loại đứng sau nó trong dãy hoạt động hoá học để tạo thành nhôm oxit và kim loại tương ứng.
7. Bài tập liên quan
Ví dụ 1: Khử hoàn toàn 16 gam bột Fe2O3 bằng bột nhôm. Hãy cho biết khối lượng bột nhôm cần dùng?
A. 2,7 gam.
B. 8,1 gam.
C. 5,4 gam.
D.10,2 gam.
Hướng dẫn giải
Chọn C.
Fe2O3 + 2Al 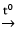
nFe2O3=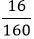
mAl=0,2.27=5,4 gam
Ví dụ 2: Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe2O3 và Al2O3
D. Al2O3, Fe và Fe2O3
Hướng dẫn giải
Chọn D.
Fe2O3 + 2Al 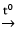
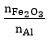
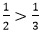
⇒ Sau phản ứng hỗn hợp là: Al2O3, Fe và Fe2O3 dư.
Ví dụ 3: Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
A. 61,5 g
B. 56,1 g
C. 65,1g
D. 51,6 g
Hướng dẫn giải
Chọn B.
Áp dụng định luật bảo toàn khối lượng ta có:
mchất rắn=mAl+mFe2O3=8,1+48=56,1 gam
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2