Tailieumoi.vn xin giới thiệu đến các quý Thầy/Cô Giáo án Hóa học 10 Bài 10: Liên kết ion sách Cánh diều theo mẫu Giáo án chuẩn của Bộ GD&ĐT. Hi vọng tài liệu này sẽ giúp Giáo viên dễ dàng biên soạn giáo án Hóa học 10. Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Chỉ 300k mua trọn bộ Giáo án Hóa học 10 Cánh diều bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official
Xem thử tài liệu tại đây: Link tài liệu
Ngày soạn: .../.../...
Ngày dạy: .../.../...
|
Trường: …………………….. Tổ: …………………………. |
Họ tên giáo viên dạy: ……………………………… |
BÀI 10. LIÊN KẾT ION (02 tiết)
I. MỤC TIÊU
1) Kiến thức
Học xong bài này, học sinh có thể:
- Trình bày được khái niệm và sự hình thành liên kết ion (nêu một số ví dụ điển hình tuân theo quy tắc octet).
- Nêu được cấu tạo tinh thể NaCl. Giải thích được vì sao các hợp chất ion thường ở trạng thái rắn trong điều kiện thường (dạng tinh thể ion).
- Lắp được mô hình tinh thể NaCl (theo mô hình có sẵn).
2) Năng lực
a) Năng lực chung
- Năng lực tự chủ và tự học: học sinh xác định đúng đắn động cơ, thái độ học tập, tự đánh giá và điều chỉnh được kế hoạch học tập; tự nhận ra được những sai sót và khắc phục.
- Năng lực giao tiếp: tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: học sinh xác định được nhiệm vụ của tổ/ nhóm, trách nhiệm của bản thân, đề xuất được những ý kiến đóng góp, góp phần hoàn thành nhiệm vụ học tập.
b) Năng lực chuyên biệt
- Năng lực nhận thức hóa học:
+ Trình bày được khái niệm liên kết ion.
+ Mô tả được sự hình thành liên kết ion, vận dụng vào một số trường hợp cụ thể.
+ Nêu được khái niệm và đặc điểm của tinh thể ion.
+ Lắp ráp được mô hình tinh thể ion.
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Thông qua các kiến thức đã học kết hợp với thông tin trong SGK, học sinh tự lực thu nhận kiến thức về liên kết ion.
- Năng lực vận dụng kiến thức, kỹ năng đã học:
+ Vận dụng đặc điểm của liên kết ion giải thích được lí do vì sao các hợp chất ion thường là tinh thể rắn ở điều kiện thường, các hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
+ Thực hành nuôi cấy được tinh thể muối ăn.
3) Phẩm chất
- Yêu nước: nhận biết được vẻ đẹp của tự nhiên, của đất nước thông qua bộ môn Hóa học.
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao đúng tiến độ.
- Trung thực: thành thật trong việc thu thập các tài liệu, viết báo cáo và các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Giáo viên: Sưu tầm hình ảnh, video mô phỏng nội dung có liên quan đến bài học; thiết kế phiếu học tập; dụng cụ lắp ráp mô hình NaCl.
- Học sinh: Ôn tập bài cũ và chuẩn bị bài mới.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu: Tạo tình huống có vấn đề và tâm lý hứng thú cho HS khi bắt đầu bài học mới.
b) Nội dung: GV trình bày vấn đề, HS lắng nghe và trả lời câu hỏi.
c) Sản phẩm:
- Câu trả lời của học sinh:
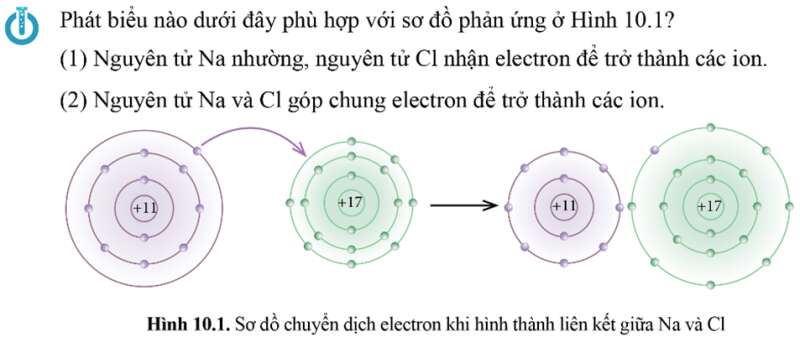
Phát biểu đúng: (1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion.
Cụ thể theo sơ đồ ta thấy:
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
- HS biết được những vấn đề liên quan đến bài học mới.
d) Tổ chức thực hiện: GV yêu cầu HS trả lời câu hỏi trong SGK:
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
................................................
................................................
................................................
Tài liệu có 14 trang, trên đây trình bày tóm tắt 5 trang của Giáo án Hóa hoc 10 Cánh diều Bài 10: Liên kết ion.
Xem thêm các bài giáo án Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Giáo án Bài 11: Liên kết cộng hóa trị
Giáo án Bài 12: Liên kết hydrogen và tương tác van der Waals
Giáo án Bài 13: Phản ứng oxi hóa – khử
Để mua Giáo án Hóa học 10 Cánh diều năm 2025 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/