Tailieumoi.vn xin giới thiệu đến các quý Thầy/Cô Giáo án Hóa học 10 Bài 10: Liên kết cộng hóa trị sách Chân trời sáng tạo theo mẫu Giáo án chuẩn của Bộ GD&ĐT. Hi vọng tài liệu này sẽ giúp Giáo viên dễ dàng biên soạn giáo án Hóa học 10. Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Chỉ 300k mua trọn bộ Giáo án Hóa học 10 Chân trời sáng tạo bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official
Xem thử tài liệu tại đây: Link tài liệu
|
Trường THPT …………. Tổ: ………………….. |
Họ và tên giáo viên ………………………….. |
|||
|
BÀI 10. LIÊN KẾT CỘNG HÓA TRỊ (6 TIẾT) |
||||
|
Tuần: |
Tiết: |
Ngày soạn: |
Thời gian thực hiện: |
|
I. MỤC TIÊU
1. Năng lực chung
- Tự chủ và tự học: Chủ động, tích cực tìm hiểu về loại liên kết hoá học hình thành giữa phi kim và phi kim, qua đó hiểu và giải thích được tính chất vật lí cũng như tính chất hoá học của các chất.
- Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt về sự hình thành liên kết cộng hoá trị; Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia thảo luận và thuyết trình.
- Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học đế hoàn thành nhiệm vụ học tập.
2. Năng lực hóa học
- Nhận thức hoá học: HS thấy được sự đa dạng của vật chất qua sự hình thành liên kết trong các hợp chất cộng hoá trị; Hiểu được tầm quan trọng của hoá học trong việc giải thích, chinh phục thế giới tự nhiên.
- Tìm hiểu thế giới tự nhiên dưới góc độ hoá học: Hoá học giúp con người khám phá, hiểu biết những bí ẩn của tự nhiên.
- Vận dụng kiến thức, kĩ năng đã học: Giải thích được cách hình thành liên kết hoá học của các hợp chất cộng hoá trị.
3. Về phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Có niềm say mê, hứng thú với việc khám phá và học tập môn hoá học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- Video về sự tạo thành liên kết cộng hoá trị; sự xen phủ AO.
- Các phiếu học tập.
2. Học sinh
- Học bài cũ, xem trước bài mới.
Tiết 1, 2: SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu: Tạo hứng thú vào bài mới, giúp HS xác định được mục tiêu học tập.
b. Nội dung: GV sử dụng câu hỏi mở đầu – SGK Hoá học 10 trang 59 để nêu vấn đề.
c. Sản phẩm: HS xác định được mục tiêu bài học và động cơ học tập.
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập Yêu cầu học sinh hoạt động cá nhân trả lời câu hỏi mở đầu – SGK Hoá 10 trang 59: Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì? |
Nhận nhiệm vụ |
|
Bước 2: Thực hiện nhiệm vụ Theo dõi và hỗ trợ HS. |
Suy nghĩ và trả lời câu hỏi. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện một học sinh báo cáo kết quả. |
Báo cáo sản phẩm: Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị. |
|
Bước 4: Kết luận và nhận định Nhận xét và dẫn dắt vào bài: Vậy liên kết cộng hoá trị là gì? Liên kết cộng hoá trị được hình thành như thế nào? Chúng ta cùng tìm hiểu trong bài học ngày hôm nay? |
|
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về sự hình thành liên kết cộng hóa trị
a. Mục tiêu: Trình bày được khái niệm, lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi, ba) khi áp dụng qui tắc octet.
b. Nội dung: HS thảo luận nhóm hoàn thành phiếu học tập số 1, từ đó lĩnh hội kiến thức.
c. Sản phẩm: Các câu trả lời của phiếu học tập 1
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
- Chuyển giao nhiệm vụ học tập Chia lớp thành 4 nhóm Yêu cầu học sinh thảo luận và trả lời câu hỏi trong phiếu học tập số 1. PHIẾU HỌC TẬP SỐ 1 1. Quan sát các Hình 10.1 đến 10.3 SGK Hoá 10 trang 59, cho biết quy tắc octet đã được áp dụng ra sao khi các nguyên tử tham gia hình thành liên kết. 2. Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2. 3. Thế nào là liên kết đơn, liên kết đôi và liên kết ba? - Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho nhóm HS - Báo cáo kết quả GV yêu cầu một số HS đại diện nhóm trình bày kết quả của nhóm. |
- Nhận nhiệm vụ - HS thảo luận và hoàn thiện kết quả theo hướng dẫn của GV: PHIẾU HỌC TẬP SỐ 1 1. Các nguyên tử đã góp chung electron khi tham gia hình thành liên kết để mỗi nguyên tử đều đạt được cấu hình electron bền vững giống khí hiếm. 2.- Sự hình thành liên kết trong phân tử HCl: Nguyên tử H có cấu hình electron là 1s1, Cl có cấu hình electron là [Ne]3s23p5. Để đạt được cấu hình bền vững của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron dùng chung cho cả hai nguyên tử. - Sự hình thành liên kết trong phân tử O2: Nguyên tử O có cấu hình electron là 1s22s22p4 . Để đạt được cấu hình bền vững của khí hiếm gần nhất, mỗi nguyên tử O đều cần thêm 2 electron. Vì vậy, mỗi nguyên tử O cùng góp 2 electron để tạo nên 2 cặp electron dùng chung cho cả hai nguyên tử. - Sự hình thành liên kết trong phân tử N2: Nguyên tử N có cấu hình electron là 1s22s22p3. Để đạt được cấu hình bền vững của khí hiếm gần nhất, mỗi nguyên tử N đều cần thêm 3 electron. Vì vậy, mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron dùng chung cho cả hai nguyên tử. 3. - Liên kết đơn là liên kết được tạo bởi 1 cặp electron dùng chung giữa hai nguyên tử. - Liên kết đôi là liên kết được tạo bởi 2 cặp electron dùng chung giữa hai nguyên tử. - Liên kết ba là liên kết được tạo bởi 3 cặp electron dùng chung giữa hai nguyên tử. – Đại diện nhóm trình bày kết quả, nhóm khác bổ sung |
|
- Kết luận + Liên kết cộng hoá trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung. ▪ Liên kết đơn là liên kết được tạo bởi 1 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng một gạch nối “–”. ▪ Liên kết đôi là liên kết được tạo bởi 2 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng hai gạch nối “=”. ▪ Liên kết ba là liên kết được tạo bởi 3 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng ba gạch nối “≡”. + Liên kết cộng hóa trị được hình thành giữa các nguyên tử giống nhau hoặc giữa các nguyên tử không khác nhau nhiều về độ âm điện (thường gặp là giữa các phi kim) |
|
Hoạt động 2: Tìm hiểu cách viết công thức Lewis
a) Mục tiêu: Viết được công thức Lewis của một số chất đơn giản.
b) Nội dung: Học sinh thảo luận nhóm, hoàn thiện phiếu học tập số 2, từ đó viết được công thức Lewis của một số chất đơn giản.
c) Sản phẩm: Kết quả phiếu học tập số 2 của HS.
d) Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
- Chuyển giao nhiệm vụ học tập Chia lớp thành 4 nhóm. Yêu cầu học sinh thảo luận và trả lời câu hỏi trong phiếu học tập số 2. PHIẾU HỌC TẬP SỐ 2 1. Nêu cách viết công thức Lewis. 2. Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4. - Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho nhóm HS - Báo cáo kết quả GV yêu cầu một số HS đại diện nhóm trình bày kết quả của nhóm. Các HS còn lại theo dõi, nhận xét. - Kết luận GV nhận xét, chốt kiến thức. |
- HS nhận nhiệm vụ. - Thảo luận thực hiện nhiệm vụ: PHIẾU HỌC TẬP SỐ 2 1. Công thức Lewis được xây dựng từ công thức electron của phân tử. Trong đó, mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được biểu thị bằng dấu gạch nối “ – “. 2.
- HS trình bày kết quả, nhận xét chéo. |
C. HOẠT ĐỘNG LUYỆN TẬP
a. Mục tiêu
- Tái hiện và vận dụng các kiến thức đã học để viết được quá trình hình thành liên kết trong phân tử Cl2, NH3.
- Viết công thức eletron, công thức Lewis, CTCT của một số chất.
b. Nội dung: HS làm việc cá nhân, hoàn thiện bài tập 2, 3 – SGK Hoá học 10 trang 66.
c. Sản phẩm: Bài làm của HS.
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Chuyển giao nhiệm vụ học tập Yêu cầu học sinh làm việc cá nhân, hoàn thiện các bài tập 2, 3 SGK hoá 10 trang 66. Thực hiện nhiệm vụ Bài tập 2: Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên. Bài tập 3: Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4. Theo dõi và hỗ trợ cho HS.
Báo cáo kết quả và thảo luận Yêu cầu đại diện HS trình bày lời giải. Kết luận: GV chuẩn hoá kiến thức. |
Nhận nhiệm vụ HS hoàn thiện bài tập: Bài 2: + Khi hình thành phân tử H2S, mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung. + Khi hình thành phân tử PH3, mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử P để tạo thành 3 cặp electron dùng chung. Bài 3:
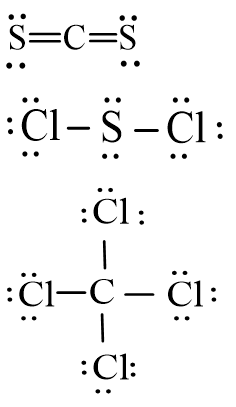
– Đại diện HS trình bày; HS khác nhận xét. |
................................................
................................................
................................................
Tài liệu có 18 trang, trên đây trình bày tóm tắt 6 trang của Giáo án Hóa hoc 10 Chân trời sáng tạo Bài 10: Liên kết cộng hóa trị.
Xem thêm các bài giáo án Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Giáo án Bài 10: Liên kết cộng hóa trị
Giáo án Bài 11: Liên kết hydrogen và tương tác van der Waals
Giáo án Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Giáo án Bài 13: Enthalpy tạo thành và sự biến thiên enthalpy của phản ứng hoá học
Để mua Giáo án Hóa học 10 Chân trời sáng tạo năm 2025 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/