Với Giải hóa học lớp 10 trang 107 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 107 Cánh diều
Bài 1 trang 107 Hóa học 10: Hãy viết phương trình hóa học để chứng minh chlorine có tính oxi hóa mạnh hơn bromine
Phương pháp giải:
Các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn
Lời giải:
Cl2 + 2NaBr → 2NaCl + Br2
=> Cl2 có tính oxi hóa mạnh hơn sẽ phản ứng với NaBr tạo thành halogen có tính oxi hóa yếu hơn là Br2
=> Chlorine có tính oxi hóa mạnh hơn bromine
Bài 2 trang 107 Hóa học 10: Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau:
NaCl (aq) + H2O (l) → A (aq) + X (g) + Y (g) (*)
Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến.
Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chlorine
a) Hãy cho biết công thức hóa học của A, X, Y
b) Hoàn thành phương trình hóa học (*)
Phương pháp giải:
- Chất tẩy rửa phổ biến là nước Javel: NaCl và NaClO
- Để sản xuất được hydrogen chloride cần: Cl2 và H2
Lời giải:
- Chất tẩy rửa phổ biến là nước Javel gồm có NaCl và NaClO
=> Hai chất tác dụng với nhau để tạo thành nước Javel là: NaOH và Cl2
- Vì A ở dạng dung dịch, Y ở dạng khí
=> A là dung dịch NaOH, Y là khí Cl2
- Để sản xuất được hydrogen chloride cần: Cl2 và H2
- Mà Y là khí Cl2
=> X là khí H2
a) Công thức hóa học của A, X, Y lần lượt là: NaOH, H2, Cl2
b) Phương trình hóa học
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g) (*)
Bài 3 trang 107 Hóa học 10: Astatine là nguyên tố phóng xạ, được xếp dưới nguyên tố iodine trong nhóm VIIA. Thực tế, các nhà khoa học chỉ thu được đồng vị bền của astatine từ quá trình nghiên cứu về phóng xạ, đồng thời nó chỉ tồn tại khoảng 8 giờ
Dựa vào xu hướng biến đổi một số tính chất của nhóm halogen, hãy dự đoán:
a) Tính oxi hóa của nguyên tử astatine mạnh hơn hay yếu hơn so với nguyên tử iodine?
b) Đơn chất astatine có màu đậm hơn hay nhạt hơn so với đơn chất iodine?
Phương pháp giải:
- Trong nhóm halogen, đi từ F đến I, tính oxi hóa giảm dần
- Trong nhóm halogen, đi từ F đến I, màu sắc đậm dần
Lời giải:
a) Trong nhóm halogen, đi từ F đến I có độ âm điện giảm dần
=> Tính oxi hóa giảm dần
=> Tính oxi hóa của nguyên tử astatine yếu hơn so với nguyên tử iodine
b) Trong nhóm halogen, đi từ F đến I có màu sắc của các đơn chất đậm dần
=> Đơn chất astatine có màu đậm hơn so với đơn chất iodine
Bài 4 trang 107 Hóa học 10: Tra cứu các giá trị năng lượng liên kết ở phụ lục 2
a) Hãy tính biến thiên enthalpy chuẩn ∆rH0298 của 2 phản ứng dưới đây:
F2(g) + H2(g) → 2HF (g)
O2(g) + 2H2(g) → 2H2O(g)
b) Ở hai phản ứng trên, fluorine và oxygen đều đóng vai trò là chất oxi hóa. Dựa vào giá trị ∆rH0298, cho biết phản ứng oxi hóa – khử nào thuận lợi hơn
Phương pháp giải:
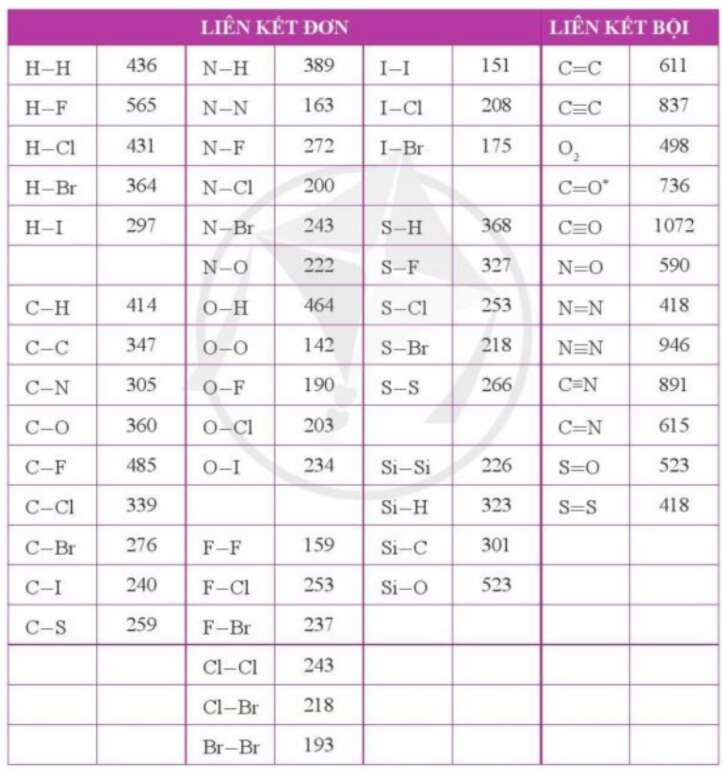
a)
∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF)
∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH)
b)
Giá trị biến thiên enthalpy nào âm hơn thì phản ứng đó diễn ra thuận lợi hơn
Lời giải:
a)
- Xét phản ứng: F2(g) + H2(g) → 2HF (g)
+ Ta có: ∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF) = 159 + 436 – 2x565 = -535 (kJ/mol)
- Xét phản ứng: O2(g) + 2H2(g) → 2H2O(g)
+ Ta có: ∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH) = 142 + 2x436 – 2x2x464 = -842 (kJ/mol)
b)
Giá trị biến thiên enthalpy của phản ứng (2) âm hơn giá trị biến thiên enthalpy của phản ứng (1)
=> Phản ứng oxi hóa – khử (2) diễn ra thuận lợi hơn
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: