Với Giải hóa học lớp 10 trang 53 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 53 Cánh diều
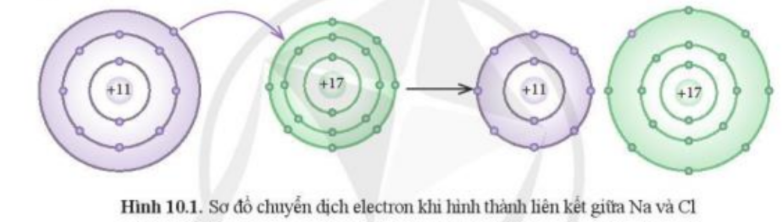
Mở đầu trang 53 Hóa học 10: Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion
Phương pháp giải:
Theo Hình 10.1
- Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron
- Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron
Lời giải:
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1
Câu hỏi 1 trang 53 Hóa học 10: Phát biểu nào sau đây là đúng?
a) Liên kết ion chỉ có trong đơn chất
b) Liên kết ion chỉ có trong hợp chất
c) Liên kết ion có trong cả đơn chất và hợp chất
Phương pháp giải:
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu (tạo nên từ kim loại điển hình và phi kim điển hình)
Lời giải:
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa ion dương (kim loại) và ion âm (phi kim)
=> Liên kết ion chỉ có trong hợp chất
Phát biểu b đúng
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: