Với Giải hóa học lớp 10 trang 39 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 39 Cánh diều
Câu hỏi 1 trang 39 Hóa học 10: Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F để giải thích về sự khác biệt bán kính nguyên tử.
Phương pháp giải:
- Dựa vào liên hệ giữa cấu hình electron nguyên tử với vị trí của nguyên tố trong bảng tuần hoàn, xác định các nguyên tố chu kì 2 có mấy lớp electron.
- Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F.
- Giải thích sự khác biệt bán kính nguyên tử dựa vào điện tích hạt nhân nguyên tử.
Lời giải:
- Các nguyên tố chu kì 2 có 2 lớp electron.
- Mô hình nguyên tử theo Rutherford – Bohr của:
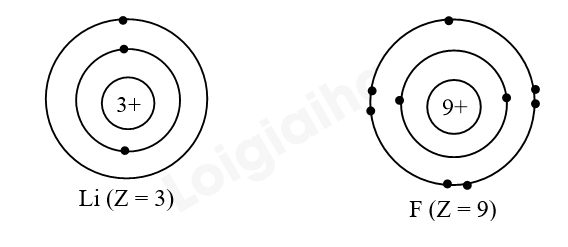
- Nguyên tố Li và F đều có 2 lớp electron nên cùng chu kì 2, số đơn vị điện tích hạt nhân của Li nhỏ hơn F. Vì vậy bán kính nguyên tử Li lớn hơn nguyên tử F.
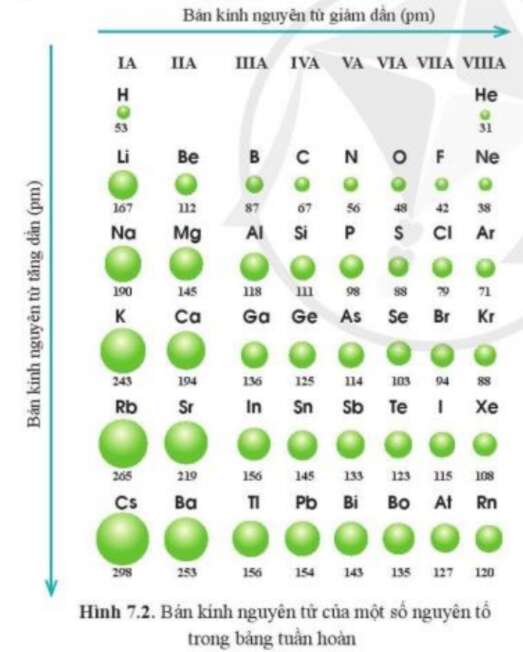
Luyện tập 1 trang 39 Hóa học 10: Quan sát hình 7.2, cho biết quy luật biến đổi bán kính nguyên tử của các nguyên tố ở chu kì 3, 4, 5 theo chiều tăng dần điện tích hạt nhân.
Phương pháp giải:
Quan sát bán kính nguyên tử các nguyên tố chu kì 3, 4, 5 theo chiều tăng dần điện tích hạt nhân.
Lời giải:
Các nguyên tố chu kì 3, 4,5 theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần từ trái quá phải.
Luyện tập 2 trang 39 Hóa học 10: Hãy giải thích vì sao nguyên tử He là nguyên tử nguyên tố có kích thước nhỏ nhất trong bảng tuần hoàn mà không phải nguyên tử H.
Phương pháp giải:
Dựa vào quy luật biến đổi bán kính nguyên tử trong cùng một chu kì.
Lời giải:
Nguyên tử He (Z = 2) và H (Z = 1) cùng thuộc chu kì 1, mà số đơn vị điện tích hạt nhân của He lớn hơn H. Vì vậy, bán kính nguyên tử của He nhỏ hơn H và nhỏ nhất trong bảng tuần hoàn.
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: