Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học sách Chân trời sáng tạo. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 10. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học. Mời các bạn đón xem:
Trắc nghiệm Hóa học 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Phần 1: Trắc nghiệm Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Câu 1. Hiện tượng nào dưới đây thể hiện ảnh hưởng của nhiệt độ đến tốc độ phản ứng?
A. Thanh củi được chẻ nhỏ hơn thì sẽ cháy nhanh hơn;
B. Quạt gió vào bếp than để thanh cháy nhanh hơn;
C. Thức ăn lâu bị ôi thiu hơn khi để trong tủ lạnh;
D. Các enzyme làm thúc đẩy các phản ứng sinh hóa trong cơ thể.
Đáp án đúng là: C
Thanh củi được chẻ nhỏ hơn thì sẽ cháy nhanh hơn ⇒ tăng diện tích bề mặt của củi ⇒ Yếu tố diện tích tiếp xúc.
Quạt gió vào bếp than để than cháy nhanh hơn ⇒ tăng nồng độ oxygen cho phản ứng cháy ⇒ Yếu tố nồng độ.
Thức ăn lâu bị ôi thiu hơn khi để trong tủ lạnh ⇒ giảm nhiệt độ để các phản ứng phân hủy diễn ra chậm hơn ⇒ Yếu tố nhiệt độ.
Các enzyme làm thúc đẩy các phản ứng sinh hóa trong cơ thể ⇒ enzyme là chất xúc tác sinh học. ⇒ Yếu tố xúc tác.
Câu 2. Cho phản ứng: 2CO (g) + O2 (g) ⟶ 2CO2 (g)
Với hệ số nhiệt độ Van’t Hoff . Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
A. tăng gấp 2 lần;
B. tăng gấp 8 lần;
C. giảm 4 lần;
D. tăng gấp 6 lần.
Đáp án đúng là: B
Ta có: = ⇒ = = 23 = 8
⇒ Tốc độ phản ứng tăng gấp 8 lần.
Câu 3. Cho hiện tượng sau: Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất.
Hiện tượng trên thể hiện ảnh hưởng của yếu tố nào đến tốc độ phản ứng?
A. Nồng độ;
B. Nhiệt độ;
C. Diện tích bề mặt tiếp xúc;
D. Chất xúc tác.
Đáp án đúng là: A
Khi cho tàn đóm vào bình oxygen nguyên ⇒ nồng độ oxygen tăng cao (vì oxygen nguyên chất có nồng độ cao hơn oxygen trong không khí) ⇒ nồng độ oxi tăng làm cho tốc độ phản ứng tăng ⇒ tàn đóm đỏ bùng cháy.
Câu 4. Người ta vận dụng yếu tố nào để tăng tốc độ phản ứng trong trường hợp sau: Nung hỗn hợp bột đá vôi, đất sét và thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất xi măng.
A. Nồng độ;
B. Nhiệt độ;
C. Áp suất;
D. Chất xúc tác.
Đáp án đúng là: B
Nung ở nhiệt độ cao để tốc độ phản ứng sản xuất xi măng xảy ra nhanh ⇒ vận dụng yếu tố nhiệt độ để tăng tốc độ phản ứng.
Câu 5. Phản ứng trong thí nghiệm nào dưới đây có tốc độ lớn nhất?
A. a gam Zn (hạt) + dung dịch HCl 0,2M ở 30°C;
B. a gam Zn (bột) + dung dịch HCl 0,2M ở 30°C;
C. a gam Zn (hạt) + dung dịch HCl 0,2M ở 40°C;
D. a gam Zn (bột) + dung dịch HCl 0,2M ở 40°C.
Đáp án đúng là: D
Zn (s) + 2HCl (aq) ⟶ ZnCl2 (aq) + H2 (g)
Cùng 1 lượng Zn thì Zn dạng bột sẽ có diện tích tiếp xúc bề mặt lớn hơn nên tốc độ phản ứng sẽ nhanh hơn.
Nhiệt độ càng cao thì tốc độ phản ứng càng nhanh, do đó ở nhiệt độ 40°C tốc độ phản ứng cao hơn ở 30°C.
Vậy thí nghiệm a gam Zn (bột) + dd HCl 0,2M ở 40°C sẽ có tốc độ phản ứng lớn nhất.
Câu 6. Tốc độ phản ứng phụ thuộc vào các yếu tố
A. nồng độ, áp suất
B. nhiệt độ
C. chất xúc tác, diện tích bề mặt
D. Cả A, B và C
Đáp án đúng là: D
Tốc độ phản ứng phụ thuộc vào các yếu tố: nồng độ, áp suất, nhiệt độ, chất xúc tác, diện tích bề mặt.
Câu 7. Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức
A. =
B. =
C. =
D. =
Đáp án đúng là: A
Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức: =
Trong đó, và là tốc độ phản ứng ở 2 nhiệt độ t1 và t2; γ là hệ số nhiệt độ Van’t Hoff.
Câu 8. Kết luận nào sau đây sai?
A. Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng;
B. Khi tăng nhiệt độ, tốc độ phản ứng tăng;
C. Đối với tất cả các phản ứng, tốc độ phản ứng tăng khi áp suất tăng;
D. Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
Đáp án đúng là: C
Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi áp suất tăng.
Do đó kết luận C sai.
Câu 9. Chất làm tăng tốc độ phản ứng hóa học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng là
A. chất xúc tác;
B. chất ban đầu;
C. chất sản phẩm;
D. Cả A, B và C đều sai.
Đáp án đúng là: A
Chất làm tăng tốc độ phản ứng hóa học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng là chất xúc tác.
Câu 10. Khi đốt than trong lò, đậy nắp lò sẽ giữ than cháy được lâu hơn.
Yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng trong ví dụ trên là
A. nhiệt độ;
B. nồng độ;
C. chất xúc tác;
D. diện tích bề mặt tiếp xúc.
Đáp án đúng là: B
Yếu tố nồng độ.
Đậy nắp lò sẽ làm giàm nồng độ oxygen tham gia phản ứng đốt cháy than, do đó tốc độ phản ứng giảm nên than cháy được lâu hơn.
Câu 11. Hệ số nhiệt độ Van’t Hoff của một phản ứng là . Tốc độ phản ứng thay đổi như thế nào khi giảm nhiệt độ phản ứng từ 80°C về 60°C?
A. giảm 9 lần;
B. tăng 3 lần;
C. giảm 6 lần;
D. tăng 9 lần.
Đáp án đúng là: A
Ta có: = ⇒ = = 3−2 = 1/9
⇒ Tốc độ phản ứng giảm 9 lần.
Câu 12. Phát biểu nào sau đây sai?
A. Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn;
B. Áp suất của các chất khí tham gia phản ứng càng lớn, tốc độ phản ứng càng lớn;
C. Diện tích bề mặt càng nhỏ, tốc độ phản ứng càng lớn;
D. Nhiệt độ càng cao, tốc độ phản ứng càng lớn.
Đáp án đúng là: C
Diện tích bề mặt càng nhỏ, tốc độ phản ứng càng lớn ⇒ sai. Vì diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
Câu 13. Cho phản ứng sau: 2KMnO4 (s) → K2MnO4 (s) + MnO2 (s) + O2 (g). Yếu tố không ảnh hưởng đến tốc độ của phản ứng này là:
A. Nhiệt độ;
B. Kích thước KMnO4 (s);
C. Áp suất;
D. Cả A, B và C.
Đáp án đúng là: C
2KMnO4 (s) → K2MnO4 (s) + MnO2 (s) + O2 (g)
Phản ứng trên không có chất tham gia là chất khí nên yếu tố áp suất không ảnh hưởng đến tốc độ phản ứng này.
Câu 14. Người ta sử dụng phương pháp nào để tăng tốc độ phản ứng trong trường hợp sau: Nén hỗn hợp khí N2 và H2 ở áp suất cao để tổng hợp NH3.
A. Tăng nhiệt độ;
B. Tăng áp suất;
C. Tăng thể tích;
D. Tăng diện tích bề mặt tiếp xúc.
Đáp án đúng là: B
Nén hỗn hợp khí N2 và H2 ở áp suất cao để làm tăng áp suất, tốc độ phản ứng tổng hợp NH3 tăng.
Câu 15. Thí nghiệm cho 7 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 3M ở nhiệt độ thường. Tác động nào sau đây không làm tăng tốc độ của phản ứng?
A. Thay 7 gam kẽm hạt bằng 7 gam kẽm bột;
B. Dùng dung dịch H2SO4 4M thay dung dịch H2SO4 3M;
C. Tiến hành ở 40°C;
D. Làm lạnh hỗn hợp
Đáp án đúng là: D
Thay 7 gam kẽm hạt bằng 7 gam kẽm bột ⇒ Diện tích bề mặt tiếp xúc của kẽm tăng ⇒ tốc độ phản ứng tăng.
Dùng dung dịch H2SO4 4M thay dung dịch H2SO4 3M⇒ Nồng độ H2SO4 tăng ⇒ tốc độ phản ứng tăng.
Tiến hành ở 40°C cao hơn nhiệt độ thường ⇒ tăng nhiệt độ ⇒ tốc độ phản ứng tăng.
Làm lạnh hỗn hợp không làm tăng tốc độ phản ứng.
Phần 2: Lý thuyết Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
I. Ảnh hưởng của nồng độ
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Nồng độ của các chất phản ứng tăng làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
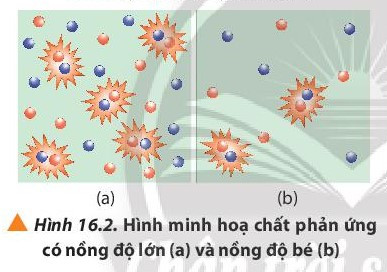
Chú ý: Khi các chất phản ứng va chạm đúng hướng và đủ năng lượng dẫn đến xảy ra phản ứng, gọi là va chạm hiệu quả.
Ví dụ: Phản ứng hóa học: Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
Nồng độ Na2S2O3 giảm ⇒ Các hạt phân tử Na2S2O3 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
II. Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ, tốc độ phản ứng tăng.
- Giải thích: Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ; khi tăng nhiệt độ; các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
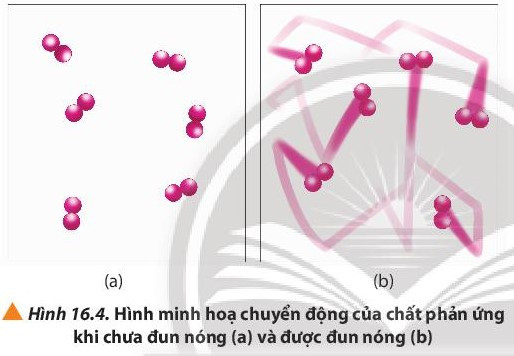
- Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức:
Trong đó:
+ là tốc độ phản ứng ở hai nhiệt độ t1 và t2;
+ γ là hệ số nhiệt độ Van’t Hoff.
Chú ý: Quy tắc Van’t Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
III. Ảnh hưởng của áp suất
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
- Giải thích: Khi tăng áp suất thì nồng độ chất khí tăng, nên tốc độ phản ứng tăng.

IV. Ảnh hưởng của bề mặt tiếp xúc
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Khi tăng diện tích tiếp xúc của chất phản ứng, số va chạm hiệu quả tăng dẫn đến tốc độ phản ứng tăng.
- Ví dụ: Thực hiện các thí nghiệm sau:
+ Thí nghiệm 1: Cho 2 gam CaCO3 dạng khối tác dụng với 20 ml HCl 1M;
+ Thí nghiệm 2: Cho 2 gam CaCO3 dạng bột tác dụng với 20 ml HCl 1M.
Khi HCl phản ứng với CaCO3 dạng bột, diện tích tiếp xúc giữa các phân tử HCl và CaCO3 tăng lên
⇒ Số va chạm hiệu quả tăng ⇒ tốc độ phản ứng tăng.
⇒ Ở thí nghiệm 2 phản ứng diễn ra nhanh hơn.
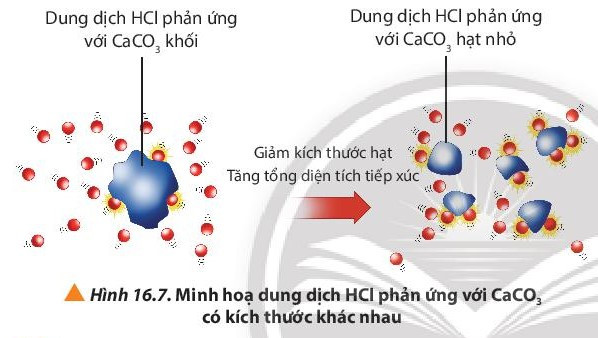
V. Ảnh hưởng của chất xúc tác
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
- Chất xúc tác được ghi trên mũi tên trong phương trình hóa học.
Ví dụ 1: Phương trình hóa học của phản ứng:
2H2O2 (aq) 2H2O (l) + O2 (g)
Trong phản ứng trên MnO2 là chất xúc tác.
Ví dụ 2: Enzyme amylase có trong nước bọt là chất xúc tác đẩy nhanh quá trình tiêu hóa tinh bột.
VI. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
- Kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả.
Ví dụ:
+ Nồng độ oxygen trong không khí chỉ chiếm 21%. Dùng bình chứa oxygen mục đích làm tăng nồng độ chất tham gia ⇒ Tăng tốc độ phản ứng cháy
+ Bảo quản thức ăn trong tủ lạnh ⇒ Giảm nhiệt độ ⇒ Giảm tốc độ phản ứng oxi hóa thức ăn ⇒ Thức ăn lâu bị ôi thiu.

Xem thêm các bài trắc nghiệm Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Trắc nghiệm Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Trắc nghiệm Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Trắc nghiệm Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Trắc nghiệm Hóa 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Trắc nghiệm Hóa 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide