Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 9 Bài 42: Luyện tập chương 4 - Hiđrocacbon. Nhiên liệu chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 9. Mời các bạn đón xem:
Giải SBT Hóa học 9 Bài 42: Luyện tập chương 4 - Hiđrocacbon. Nhiên liệu
Bài 42.1 trang 51 SBT Hóa học 9: Viết các phương trình hoá học của phản ứng đốt cháy các chất sau
Phương pháp giải:
Viết PTHH với sản phẩm cháy là CO2 và H2O
Lời giải:
Bài 42.2 trang 52 SBT Hóa học 9: Nêu phương pháp phân biệt các bình đựng riêng biệt các chất khí sau :
a) CH4 ; C2H2 ; SO2.
b) C2H6 ; C2H4 ; H2.
Phương pháp giải:
Dựa vào tính chất hóa học khác nhau và một số hiện tượng đặc trưng như kết tủa, mất màu...
Lời giải:
a)
- Dẫn các khí qua dung dịch Ca(OH)2 dư, xuất hiện kết tủa => SO2 => hai hiđrocacbon thoát ra.
Ca(OH)2 + SO2 → CaSO3↓ + H2O
- Dẫn hai khí còn lại vào dung dịch nước brom dư, dung dịch bị mất màu => C2H2 => khí thoát ra là CH4
C2H2 + 2Br2 → C2H2Br4
b)
- Dẫn các khí vào dung dịch nước brom dư, dung dịch bị mất màu => C2H4 => khí thoát ra là C2H6 và H2
C2H4 + Br2 → C2H4Br2
- Đốt cháy hai khí đó, rồi dẫn sản phẩm vào dung dịch nước vôi trong dư, xuất hiện kết tủa => C2H6 vì sản phẩm cháy sinh ra CO2
C2H6 + O2 → 2CO2 + 3H2O
2H2 + O2 → 2H2O
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Bài 42.3 trang 52 SBT Hóa học 9: A, B, C là ba hiđrocacbon khi đốt cháy đều thu được số mol khí CO2 bằng hai lần số mol hiđrocacbon đem đốt. Biết :
A không làm mất màu dung dịch brom.
Một mol B tác dụng được tối đa với 1 mol brom.
Một mol C tác dụng được tối đa với 2 mol brom.
Hãy xác định công thức phân tử và công thức cấu tạo của A, B, C.
Phương pháp giải:
Dựa vào sản phẩm cháy nhận thấy 3 hiđrocacbon đều có 2 nguyên tử C. A không làm mất màu nước brom nên không có liên kết π, 1 mol B + 1 mol brom => B có 1 π; 1 mol C + 2 mol brom => C có 2 π.
Lời giải:
Gọi công thức của ba hiđrocacbon đó là : CxHy, CaHb, CnHm.
Khi đốt ta có :
Vì số mol CO2 tạo ra bằng 2 lần số mol hiđrocacbon đem đốt. Vậy theo phương trình hoá học của phản ứng cháy
-----> x = a = n = 2.
Mặt khác : A không làm mất màu nước brom —> không có liên kết đôi hoặc ba. Vậy A là CH3 - CH3.
1 mol B chỉ tác dụng tối đa với 1 mol brom -----> có 1 liên kết đôi.
Vậy B là CH2 = CH2.
1 mol C tác dụng tối đa với 2 mol brom ------> có liên kết ba.
Vậy C là CH CH.
Bài 42.4 trang 52 SBT Hóa học 9: Hiđrocacbon X có công thức phân tử là C4H10
a) Viết các công thức cấu tạo của X.
b) Biết X có phản ứng thế với clo (clo thế hiđro ở vị trí bất kì) khi có ánh sáng. Hãy viết phương trình hoá học của phản ứng xảy ra khi cho X tác dụng với Cl2 theo tỉ lệ 1 : 1 về số mol để tạo ra C4H9Cl.
c) Viết các công thức cấu tạo có thể có của C4H9Cl
Phương pháp giải:
Viết phương trình hóa học xảy ra. Phản ứng giữa C4H10 và Cl2 là phản ứng thế, thay 1 nguyên tử Cl bằng 1 nguyên tử H.
Lời giải:
a) Công thức cấu tạo của X có thể là:
hoặc
b) Phản ứng thế của X với clo theo tỷ lệ 1:1 khi chiếu sáng:
c) Vì nguyên tử clo có thể thay thế nguyên tử hidro ở vị trí bất kì trong X nên;
+ Nếu X là , công thức cấu tạo của C4H9Cl có thể là:
hoặc
+ Nếu X là , thì công thức cấu tạo của C4H9Cl có thể là:
hoặc
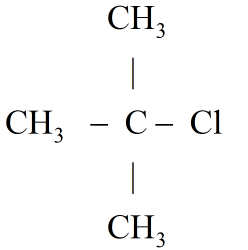
Bài 42.5 trang 52 SBT Hóa học 9: Hỗn hợp A gồm CH4, C2H2 và một hiđrocacbon X có công thức CnH2n+2 .Cho 0,896 lít hỗn hợp A đi qua dung dịch brom dư để phản ứng xảy ra hoàn toàn, thấy thoát ra 0,448 lít hỗn hợp hai khí.
Biết rằng tỉ lệ số mol của CH4 và CnH2n+2trong hỗn hợp là 1 : 1, khi đốt cháy 0,896 lít A thu được 3,08 gam khí C02 (thể tích khí đo ở đktc).
a) Xác định công thức phân tử của hiđrocacbon X.
b) Tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp A.
Phương pháp giải:
Viết và tính toán theo PTHH.
Lời giải:
a) Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C2H2 + 2Br2 —> C2H2Br4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH4 và CnH2n+2
Theo đề bài, tham gia phản ứng là : 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C2H2 là
Gọi số mol của CH4 là x. Theo bài => số mol của CnH2n+2 cũng là x.
Vậy ta có :
Phương trình hoá học của phản ứng.đốt cháy hỗn hợp :
0,02mol 0,04mol
0,01mol 0,01mol
0,01 mol 0,01n mol
Vậy ta có :
Công thức phân tử của hiđrocacbon X là C2H6.
b) Thành phần phần trăm thể tích các khí
Bài 42.6 trang 52 SBT Hóa học 9: Hiđrocacbon A, B mạch hở có tỉ khối đối với H2 tương ứng là 22 và 13.
a) Xác định công thức phân tử và công thức cấu tạo của A, B.
b) Dẫn 5,6 lít hỗn hợp A, B có tỉ khối đối với H2 là 18,4 qua dung dịch nước brom dư sao cho phản ứng xảy ra hoàn toàn. Hãy tính khối lượng brom đã tham gia phản ứng (biết thể tích khí đo ở đktc).
Phương pháp giải:
Biện luận CTPT dựa vào M (số nguyên tử H luôn là số chẵn). Viết và tính toán theo PTHH.
Lời giải:
a) Ta có
Gọi công thức của A là
Công thức của A là
- Tương tự ta có công thức của B là
Công thức cấu tạo của B là
b) Gọi số mol của có trong hỗn hợp là x -->
Ta có:
Phương trình hóa học :
0,1 ------> 0,2 (mol)
Vậy đã phản ứng là:
0,2 x 160 = 32(gam)