Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 9 Bài 22: Luyện tập chương 2 - Kim loại chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 9. Mời các bạn đón xem:
Giải SBT Hóa học 9 Bài 22: Luyện tập chương 2 - Kim loại
Bài 22.1 trang 27 SBT Hóa học 9: Kim loại nhôm và kim loại sắt có những tính chất hóa học nào giống nhau và khác nhau ? Dẫn ra những phản ứng hoá học để minh hoạ.
Lời giải:
- Tác dụng với phi kim tạo oxit hoặc muối.
4Al + 3O2 → 2Al2O3
3Fe + 2O2 → Fe3O4
2Al + 3Cl2 → 2AlCl3
2Fe + 3Cl2 → 2FeCl3
- Tác dụng với axit (HCl, H2SO4 loãng) giải phóng khí hiđro ; Nhưng không tác dụng với H2SO4 đặc, nguội và HNO3 đặc, nguội.
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
- Tác dụng với dung dịch của một số muối.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Fe + CuSO4 → FeSO4 + Cu
- Al tan trong dung dịch kiềm, Fe không tan trong dung dịch kiềm.
2Al + 2NaOH + 2H2O ---> 2NaAlO2 + 3H2
- Al tác dụng với các chất tạo hợp chất trong đó Al có hoá trị duy nhất là III, Fe tác dụng với các chất tạo hợp chất trong đó Fe có hoá trị II, hoá trị III.
2Al + 3Cl2 → 2AlCl3
2Al + 6HCl → 2AlCl3 + 3H2
2Fe + 3Cl2 → 2FeCl3
Fe + 2HCl → FeCl2 + H2
- Al là kim loại hoạt động hoá học mạnh hơn Fe :
2Al + Fe2O3 ----------> 2Fe + Al2O3
Bài 22.2 trang 27 SBT Hóa học 9: Có một dung dịch gồm hai muối: Al2(SO4)3 và FeSO4. Trình bày một phương pháp hoá học để từ dung dịch trên điều chế ra dung dịch Al2(SO4)3. Viết phương trình hoá học.
Phương pháp giải:
Vận dụng tính chất kim loại mạnh đẩy kim loại yếu ra khỏi muối của kim loại yếu hơn.
Lời giải:
Cho một lượng bột Al dư vào dung dịch 2 muối, chỉ có Al tác dụng với dung dịch muối FeSO4 :
2Al + 3FeSO4 ----------> Al2(SO4)3 + 3Fe.
Tách kết tủa thu được dung dịch Al2(SO4)3.
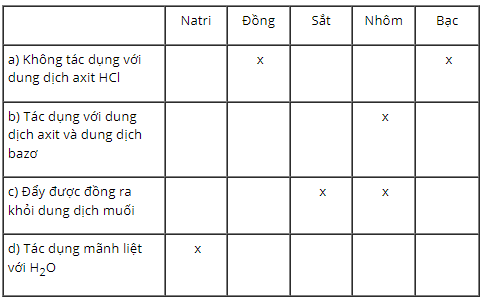
Bài 22.3 trang 27 SBT Hóa học 9: Trong phòng thí nghiệm có các kim loại sau : natri, đồng, sắt, nhôm, bạc.
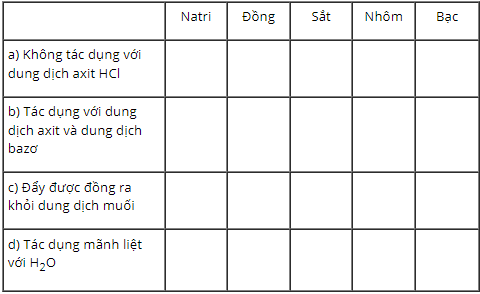
Lời giải:
Bài 22.4 trang 27 SBT Hóa học 9: Một phần dãy hoạt động hoá học của kim loại được viết như sau :
Mg Zn Fe Pb Cu Ag
Phát biểu nào sau đây là đúng ?
A. Kim loại magie có thể thế chỗ kim loại kẽm trong dung dịch muối.
B. Kim loại sắt có thể thế chỗ kim loại kẽm trong dung dịch muối.
C. Kim loại chì có thể thế chỗ kim loại sắt trong dung dịch muối.
D. Kim loại bạc có thể thế chỗ kim loại đồng trong dung dịch muối.
Lời giải:
Mg + ZnSO4 → MgSO4 + Zn
Đáp án A.
Bài 22.5 trang 28 SBT Hóa học 9: Có các kim loại : Al, Na, Cu, Ag.
a) Sắp xếp các kim loại trên theo thứ tự mức độ hoạt động hoá học tăng dần.
b) Chọn những phản ứng hoá học thích hợp để chứng minh cho sự sắp xếp các kim loại. Viết các phương trình hoá học.
Lời giải:
a) Sắp xếp theo thứ tự hoạt động hoá học tăng dần : Ag, Cu, Al, Na.
b) Phương trình hoá học chứng minh.
- Na tác dụng mãnh liệt với H2O còn Al tác dụng chậm :
2Na + 2H2O —---> 2NaOH + H2
- Kim loại Al và Na tác dụng với dung dịch HCl, còn Ag, Cu không tác dụng :
2Al + 6HCl —---> 2AlCl3 + 3H2
2Na + 2HCl —---> 2NaCl + H2
- Khi cho các kim loại Cu, Ag tác dụng với oxi chỉ có Cu tác dụng, còn Ag không tác dụng :
2Cu + O2 —---> 2CuO
Bài 22.6 trang 28 SBT Hóa học 9: Viết phương trình hoá học biểu diễn chuyển đổi hoá học sau :
Lời giải:
Phương trình hóa học :
Bài 22.7 trang 28 SBT Hóa học 9: Cho một lá sắt có khối lượng 5 gam vào 50 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô, cân nặng 5,16 gam.
a) Viết phương trình hoá học.
b) Tính nồng độ phần trăm các chất còn lại trong dung dịch sau phản ứng.
Phương pháp giải:
Áp dụng phương pháp tăng-giảm khối lượng:
- 1 mol Fe phản ứng thu được 1 mol Cu, khối lượng kim loại tăng: 8 gam.
- Tính khối lượng tăng thực tế → số mol và khối lượng các chất đã phản ứng và muối sắt (II) sunfat sinh ra.
- Khối lượng dung dịch sau phản ứng bằng khối lượng dung dịch và chất tham gia trừ khối lượng Cu tách ra khỏi dung dịch
Lời giải:
a) Phương trình hoá học :
Fe + CuSO4 ---------> FeSO4 + Cu
Khối lượng dung dịch CuSO4 : mdd CuS04 = 1,12 x 50 = 56 (gam).
b)
CuSO4 + Fe --------> FeSO4 + Cu
1mol 1 mol 1 mol 1 mol
x moi x mol x mol x mol
64x — 56x = 5,16 - 5 = 0,16 (gam) => x = 0,02 mol.
mCuS04 tham gia phản ứng = 0,02 x 160 = 3,2 (gam);
100 gam dung dịch CuSO4 có 15 gam CuSO4 nguyên chất.
56 gam dung dịch CuSO4 có X gam CuSO4 nguyên chất.
m FeSO4 = 0,02 x 152 = 3,04 (gam).
mdd sau phản ứng = 56 - 0,16 = 55,84 (gam).
Bài 22.8 trang 28 SBT Hóa học 9: Cho 10 gam hỗn hợp bột các kim loại sắt và đồng vào dung dịch CuSO4 dư. Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn có khối lượng 11 gam. Thành phần phần trăm theo khối lượng của sắt và đồng trong hỗn hợp đầu là
A. 35% và 65% ; B. 40% và 60% ;
C. 70% và 30% ; D. 50% và 50%.
Phương pháp giải:
Viết phương trình hóa học, chỉ có Fe tác dụng với dung dịch CuSO4 nên từ khối lượng ban đầu và khối lượng chất rắn có thể tìm số mol của Fe.
Lời giải:
Fe + CuSO4 ------- > FeSO4 + Cu
1 mol 1 mol 1 mol 1 mol
x mol x mol x mol x mol
Khối lượng Fe phản ứng (cũng là khối lượng sắt trong hỗn hợp đầu) là 56x. Khối lượng Cu sinh ra 64x.
CuSO4 dư nên chất rắn sau phản ứng là đồng :
10 - 56x + 64x = 11 ------>
mFe trong hỗn hợp đầu là:
Đáp án C.
Bài 22.9 trang 28 SBT Hóa học 9:
Cho 6,5 gam muối sắt clorua tác dụng với dung dịch AgN03 dư thu được 17,22 gam kết tủa. Công thức phân tử của muối sắt clorua là công thức nào dưới đây ? (Hiệu suất phản ứng đạt 100%).
A. FeCl2 ; B. FeCl3 ;
C. FeCl ; D. FeCl4.
Phương pháp giải:
Đặt công thức của muối sắt, viết phương trình hóa học và tính toán để tìm hóa trị của sắt.
Lời giải:
Đặt công thức muối sắt clorua là FeCln
FeCln + nAgNO3 —---> nAgCl + Fe(NO3)n
(56 + 35,5n) g n(108 + 35,5) g
6,5 g 17,22 g
Ta có phương trình :
6,5 x n(108 + 35,5) = 17,22 x (56 + 35,5n)
n = 3 —> FeCl3.
Đáp án B.
Bài 22.10 trang 28 SBT Hóa học 9: Người ta dùng quặng boxit để sản xuất Al. Hàm lượng Al2O3 trong quặng là 40%. Để có được 4 tấn nhôm nguyên chất cần bao nhiêu tấn quặng ? Biết rằng hiệu suất của quá trình sản xuất là 90%.
Phương pháp giải:
Từ khối lượng nhôm tính được khối lượng oxit (tính cả hiệu suất phản ứng).
Từ khối lượng theo lí thuyết chia 40% được khối lượng quặng cần dùng
Lời giải:
Thực tế do một số nguyên nhân, chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất dưới 100%. Người ta có thể tính hiệu suất phản ứng như sau :
1. Dựa vào một trong các chất tham gia phản ứng, công thức tính :
2.Dựa vào một trong các chất tạo thành, công thức tính :
2Al2O3 4 Al + 3O2
2x 102 tấn 4x 27 tấn
x tấn 4 tấn
Hiệu suất phản ứng là 90%, có nghĩa là 7,55 tấn Al2O3 chỉ chiếm 90% khối lượng phải dùng.
Khối lượng oxit phải dùng :
Khối lượng quặng boxit:
Bài 22.11 trang 28 SBT Hóa học 9: Người ta dùng 200 tấn quặng hematit hàm lượng Fe2O3 là 30% để luyện gang. Loại gang này chứa 95% Fe. Tính lượng gang thu được, biết hiệu suất của quá trình sản xuất là 96%.
Phương pháp giải:
Tính khối lượng oxit (30%) trong quặng.
Dựa vào hiệu suất tính khối lượng oxit tham gia phản ứng.
Tính theo PTHH được khối lượng sắt, chia 95% thu được khối lượng gang.
Lời giải:
Khối lượng Fe2O3 trong quặng : (tấn )
Khối lượng Fe2O3 tham gia phản ứng : (tấn )
Phương trình của phản ứng luyện gang :
Fe2O3 + 3CO —------->2Fe + 3CO2
160 tấn 112 tấn
57,6 tấn x tấn
(tấn)
Lượng sắt này hoà tan một số phụ gia (C, Si, P, S...) tạo ra gang. Khối lượng sắt chiếm 95% gang. Vậy khối lượng gang là :
(tấn)
Bài 22.12 trang 28 SBT Hóa học 9: Khi hoà tan 6 gam hợp kim gồm Cu, Fe và Al trong axit clohiđric dư thì tạo thành 3,024 lít H2 (đktc) và còn lại 1,86 gam kim loại không tan.
a) Viết các phương trình hoá học.
b) Xác định thành phần phần trăm khối lượng các kim loại.
Phương pháp giải:
Viết và tính toán theo phương trình hóa học, Cu không tác dụng với HCl nên 1,86g là khối lượng của Cu.
Lập hệ phương trình hai ẩn là số mol của Fe và Al, một phương trình tổng khối lượng của hai kim loại và một phương trình tống số mol khí sinh ra.
Từ đó tính được số mol từng chất và % khối lượng mỗi kim loại.
Lời giải:
a) Khi hoà tan hợp kim gồm 3 kim loại Fe, Cu và Al trong dung dịch HCl dư thì Cu không tác dụng, khối lượng 1,86 gam là khối lượng Cu. Gọi số mol Fe là x mol, AI là y mol.
Fe + 2HCl —---> FeCl2 + H2
x mol x mol
2Al + 6HCl —----> 2AlCl3 + 3H2
y mol mol
Ta có các phương trình :
Giải ra ta có : x = 0,045 ; y = 0,06.
mFe = 0,045 x 56 = 2,52 (gam) ; mAl = 0,06 x 27 = 1,62 (gam).
%mFe = = 42%
%mAl = = 27%
%mCu = 100% - 42% -27% = 31%
Bài 22.13 trang 29 SBT Hóa học 9: Đốt 6,7 gam hỗn hợp X gồm các kim loại Fe, Al, Cu và Ag trong không khí. Sau phản ứng thu được 8,7 gam hỗn hợp chất rắn Y. Hoà tan Y bằng dung dịch HCl dư thấy còn lại 2,7 gam một chất rắn.
a) Viết các phương trình hoá học.
b) Tính thể tích dung dịch HCl 2M vừa đủ để hoà tan Y.
Phương pháp giải:
Áo dụng định luật bảo toàn khối lượng tính khối lượng O2 tác dụng với kim loại và số mol O trong oxit.
Viết các phương trình hóa học xảy ra, nhận xét quan hệ số mol của HCl và nước. Chú ý: Ag không tác dụng với oxi.
Số mol HCl gấp đôi số mol của O trong oxit → tính thể tích dung dịch HCl 2M cần dùng.
Lời giải:
a) Phương trình hoá học của phản ứng :
Ag không tác dụng với oxi, không tác dụng với dung dịch HCl nên 2,7 gam chất rắn không tan là Ag.
Hỗn hợp kim loại với oxi.
4Al + 3O2 —>2Al2O3
3Fe + 2O2 —> Fe3O4
2Cu + O2 —> 2CuO
Hỗn hợp chất rắn Y với dung dịch HCl
Al2O3 + 6HCl —----> 2AlCl3 + 3H2O
Fe3O4 + 8HCl ------> FeCl2 + 2FeCl3 + 4H2O
CuO + 2HCl ------ > CuCl2 + H2O
Áp dụng bảo toàn khối lượng cho phản ứng của X với O2, ta có:
Bảo toàn nguyên tố Oxi:
So sánh các phản ứng của hỗn hợp Y với dung dịch HCl ta thấy nHCl = 2nO(oxit) = 2.0,125 = 0,25 mol
Bài 22.14 trang 29 SBT Hóa học 9: Để hoà tan 1,95 gam kim loại X cần dùng V ml dung dịch HCl và thu được 0,672 lít khí H2 (ở đktc). Mặt khác nếu hoà tan 1,6 gam oxit của kim loại Y cũng cần dùng V ml dung dịch HCl ở trên. Xác định hai kim loại X và Y.
Phương pháp giải:
Dựa vào phương trình hóa học và dữ kiện đề bài, biện luận về hóa trị và M của X.
Đặt CTTQ oxit của Y, viết phương trình hóa học và biện luận.
Lời giải:
Thể tích dung dịch HCl dùng cho cả 2 phản ứng bằng nhau, nên có cùng số mol. Kí hiệu X, Y là khối lượng mol nguyên tử của 2 kim loại.
Phương trình hoá học của phản ứng :
2X + 2nHCl -------> 2XCln + nH2
(mol) 0,06
Theo đề bài:
|
Kẻ bảng, ta có |
n |
1 2 |
3 |
|
X |
32,5 65 (loại) (nhận) |
97,5 (loại) |
|
Kẻ bảng, ta có |
m |
1 2 |
3 |
|
Y |
56/3 112/3 (loại) (loại) |
56 |
Bài 22.15 trang 29 SBT Hóa học 9: Hoà tan hoàn toàn 57,6 gam hỗn hợp X gồm Fe3O4, Fe2O3, FeO và Fe trong dung dịch HCl thì cần dùng 360 gam dung dịch HCl 18,25% để tác dụng vừa đủ. Sau phản ứng thu được V lít khí H2 và dung dịch Y.
Cho toàn bộ H2 sinh ra tác dụng hết với CuO dư ở nhiệt độ cao, sau phản ứng thu được hỗn hợp rắn gồm Cu và CuO có khối lượng nhỏ hơn khối lượng CuO ban đầu là 3,2 gam. Nếu cô cạn dung dịch Y thì thu được bao nhiêu gam muối khan ?
Phương pháp giải:
Viết phương trình hóa học. Nhận xét quan hệ số mol HCl và nước. Áp dụng định luật bảo toàn khối lượng để giải.
Lời giải:
(mol) x x x x
Theo đề bài:
0,4 mol 0,2 mol
Số mol HCl tác dụng với là : 1,8 -0,4=1,4(mol)
Phương trình hóa học của phản ứng:
Qua các phản ứng (1), (2), (3) ta nhận thấy
Áp dụng định luật bảo toàn khối lượng, ta có:
mhỗn hợp + mHCl = mmuối + mH2O + mH2
57,6 + 1,8 x 36,5 = mmuối + 0,7 x 18 +0,4
mmuối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (g)
Bài 22.16 trang 29 SBT Hóa học 9: Cho một lá sắt vào 160 gam dung dịch CuSO410%. Sau khi Cu bị đẩy hết ra khỏi dung dịch CuSO4 và bám hết vào lá sắt, thì khối lượng lá sắt tăng lên 4%. Xác định khối lượng lá sắt ban đầu.
Phương pháp giải:
Viết phương trình hóa học. Áp dụng phương pháp tăng-giảm khối lượng.
Lời giải:
Số mol CuSO4 =
Phương trình hóa học của phản ứng:
(mol) 0,1 0,1 0,1 0,1
Khối lượng Fe phản ứng: 0,1 . 56 =5,6(gam)
Khối lượng Cu sinh ra: 0,1 . 64 = 6,4 (gam)
Gọi x là khối lượng lá sắt ban đầu
Khối lượng lá sắt khi nhúng vào dung dịchCuSO4 tăng lên là:
Khối lượng lá sắt tăng lên = sinh ra - phản ứng
0,04x = 6,4 -5,6=0,8
=> x= 20 gam