Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 9 Bài 4: Một số axit quan trọng chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 9. Mời các bạn đón xem:
Giải SBT Hóa học 9 Bài 4: Một số axit quan trọng
Bài 4.1 trang 6 SBT Hóa học 9: Dung dịch H2SO4 loãng tác dụng được với các chất trong dãy :
A. CuO; BaCl2; NaCl; FeCO3
B. Cu; Cu(OH)2; Na2CO3; KCl
C. Fe; ZnO; MgCl2; NaOH
D. Mg; BaCl2; K2CO3; Al2O3
Lời giải:
H2SO4 loãng không phản ứng với NaCl, Cu, KCl và MgCl2
H2SO4 + Mg → MgSO4 + H2
H2SO4 + BaCl2 → BaSO4 + 2HCl
H2SO4 + K2CO3 → K2SO4 + CO2 + H2O
3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O
Đáp án D
Bài 4.2 trang 6 SBT Hóa học 9: Cần phải điều chế một lượng muối đồng sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric ?
a) Axit sunfuric tác dụng với đồng(II) oxit.
b) Axit sunfuric đặc tác dụng với đồng kim loại.
Viết các phương trình hoá học và giải thích.
Lời giải:
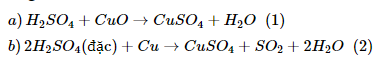
- Muốn điều chế n mol CuSO4 trong phản ứng (1) ta cần dùng n mol H2SO4
- Muốn điều chế n mol CuSO4 trong phản ứng (2) ta cần dùng 2n mol H2SO4 đặc
Do đó phương pháp điều chế CuSO4 bằng phản ứng của H2SO4 với CuO sẽ tiết kiệm được H2SO4.
Bài 4.3 trang 7 SBT Hóa học 9: Cho những chất sau : đồng, các hợp chất của đồng và axit sunfuric. Hãy viết những phương trình hoá học điều chế đồng(II) sunfat từ những chất đã cho, cần ghi rõ các điều kiện của phản ứng.
Lời giải:
Có các chất: Cu ; các hợp chất của đồng là CuO, Cu(OH)2, các muối đồng là CuCO3 hoặc CuCl2, hoặc Cu(NO3)2 ; H2SO4. Viết các phương trình hoá học và ghi điều kiện của phản ứng.
Thí dụ :
- Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
- CuO + H2SO4 → CuSO4 + H2O
- CuCO3 + H2SO4 → CuSO4 + CO2 + H2O
- Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Bài 4.4 trang 7 SBT Hóa học 9: Có 3 lọ không nhãn, mỗi lọ đựng một trong những chất rắn sau : CuO, BaCl2, Na2CO3. Hãy chọn một thuốc thử để có thể nhận biết được cả ba chất trên. Giải thích và viết phương trình hoá học.
Phương pháp giải:
Dựa vào tính chất hóa học khác nhau của mỗi hợp chất trên để lựa chọn thuốc thử hợp lý.
Lời giải:
Chọn thuốc thử là dung dịch H2SO4.
- Chất rắn tan trong dung dịch H2SO4 tạo thành dung dịch màu xanh lam là CuO.
CuO + H2SO4 → CuSO4 + H2O
xanh lam
- Chất rắn tác dụng với dung dịch H2SO4 tạo nhiều bọt khí là Na2CO3.
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
- Chất rắn tan trong dung dịch H2SO4 tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4↓+ 2HCl
trắng
Bài 4.5 trang 7 SBT Hóa học 9: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu là : HCl, H2SO4. NaCl, Na2SO4. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hoá học. Viết các phương trình hoá học.
Phương pháp giải:
Dựa vào tính chất hóa học của các hợp chất vô cơ để nhận biết bằng các phương pháp thích hợp.
Lời giải:
- Dùng quỳ tím nhận biết được HCl, H2SO4 (nhóm I) và NaCl, Na2SO4 (nhóm II).
- Phân biệt hai axit trong nhóm I bằng muối bari như BaCl2, Ba(NO3)2 hoặc bằng Ba(OH)2
→ Xuất hiện kết tủa trắng thì chất đó là H2SO4
BaCl2 + H2SO4 → BaSO4↓+ 2H2O
- Phân biệt hai muối trong nhóm II cũng dùng hợp chất của bari như đã nói ở trên
→ Xuất hiện kết tủa trắng thì chất đó là Na2SO4
BaCl2 + Na2SO4 → BaSO4↓+ 2NaCl